Với công thức đốt cháy peptit Hoá học lớp 12 chi tiết nhất giúp học sinh dễ dàng nhớ toàn bộ các công thức đốt cháy peptit từ đó biết cách làm bài tập Hoá học 12. Mời các bạn đón xem:
Công thức đốt cháy peptit hay nhất – Hoá học lớp 12
Bài toán liên quan đến đốt cháy peptit thường ở mức độ vận dụng cao, vì thế để đạt được điểm cao trong các bài kiểm tra, bài thi cần nắm chắc phương pháp giải dạng toán này. Vậy công thức giải bài toán đốt cháy peptit như thế nào? Bài viết dưới đây sẽ giúp các em sáng tỏ vấn để này.
1. Công thức đốt cháy peptit
– Peptit được hình thành từ các –amino axit no, có 1 nhóm –NH2 và 1 nhóm –COOH:
n(CxH2x+1O2N) – (n – 1) H2O → CnxH2nx– n+2NnOn+1
Trong đó:
n là số lượng nhóm –amino axit
x là số cacbon có mặt trong 1 –amino axit
naminoaxit = n.npeptit
hay npeptit =
n.(số H trong peptit) = Số H trong amino axit + 2.(n – 1)
+ Đốt cháy amino axit no, có 1 nhóm –NH2 và 1 nhóm –COOH
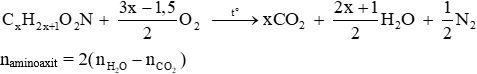
+ Đốt cháy peptit
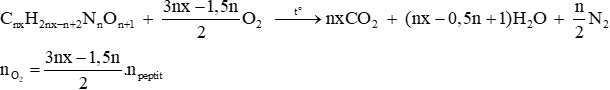
– Số mol O2 đốt cháy peptit bằng số mol của oxi khi đốt cháy từng amino axit.
Vì namino axit – (n–1)H2O = peptit mà H2O không bị đốt cháy nên số mol oxi cháy trong 2 trường hợp trên đều bằng nhau.
– Định luật bảo toàn khối lượng
– Định luật bảo toàn nguyên tố
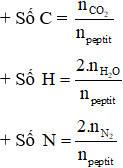
Ví dụ: X là một hexapeptit được tạo thành từ 1 –amino axit no, mạch hở có 1 nhóm –COOH và 1 nhóm –NH2. Đốt cháy hoàn toàn 0,01 mol X cần dùng vừa đủ 5,04 lít O2 (đktc) thu được sản phẩm gồm CO2, H2O, N2. Công thức phân tử của –amino axit tạo nên X là
A. C2H5NO2.
B. C3H7NO2.
C. C4H9NO2.
D. C5H11NO2.
Hướng dẫn giải
naminoaxit = 6.npeptit = 0,06 mol
Đặt công thức amino axit là : CxH2x + 1O2N 0,06 mol
Phương trình phản ứng đốt cháy amino axit no, đơn chức:
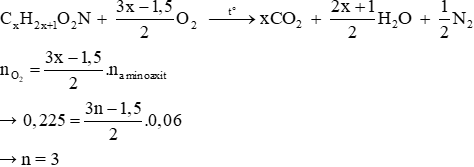
→ Công thức phân tử của amino axit là: C3H7NO2
→ Đáp án B
2. Kiến thức mở rộng
Xử lý sản phẩm cháy
– Cho sản phẩm cháy qua bình chứa NaOH (hoặc Ca(OH)2) dư
+ Nếu có kết tủa
+
+
+
3. Bài tập minh họa
Câu 1: Oligopeptit X tạo nên từ –aminoaxit Y, Y có CTPT C3H7NO2 . Khi đốt cháy hoàn toàn 0,1 mol X thì thu được 15,3 g nước. Vậy X là
A. Đipeptit
B. Tripeptit
C. Tetrapeptit
D. Pentapeptit
Hướng dẫn
Số H(trong peptit X) = =
n.Y → X + (n–1)H2O
(Với a là số lượng nhóm –aminoaxit Y)
Bảo toàn nguyên tố H
→ n.(số H trong Y) = Số H trong X + 2.(n – 1)
→ 7.n = 17 + 2(n − 1) → n = 3
→ X là tripeptit
→ Đáp án B
Câu 2: Đốt cháy hoàn toàn 0,1 mol peptit X mạch hở (tạo bởi các amino axit có công thức H2N–CnH2n–COOH) thu được 0,5 mol CO2. Mặt khác m gam X tác dụng vừa đủ với 200 ml dung dịch HCl 1M thu được dung dịch chứa a gam muối. Giá trị của a là
A. 22,3.
B. 25,1.
C. 23,7.
D. 30,7.
Hướng dẫn giải
nHCl = 0,2 = 2nX
→ X là đipeptit
Công thức chung amino axit CnH2n + 1O2N → Công thức của đipeptit C2nH4nO3N2
Số C trong X = =
→ n = 2,5
→ Mpeptit X = 146 (g/mol)
Sơ đồ phản ứng: C2nH4nO3N2 + 2HCl + H2O → muối
nHCl = 2.npeptit = 2.0,1 = 0,2 mol
= npeptit = 0,1 mol
Áp dụng định luật bảo toàn khối lượng
m pepetit + mHCl + m = m muối
→ 146.0,1 + 36,5.0,2 + 18.0,1 = m muối
→ m muối = 23,7g
→ Đáp án C
Xem thêm các công thức Hoá học lớp 12 đầy đủ, chi tiết khác:
Công thức tính hiệu suất phản ứng este hóa
Công thức phản ứng xà phòng hóa este
Công thức phản ứng xà phòng hóa chất béo
Công thức bài toán đốt cháy este
Công thức bài toán đốt cháy chất béo
Công thức tính số mắt xích tinh bột
Công thức tính số mắt xích xenlulozơ
Công thức tính nhanh số đồng phân amin, amino axit
Công thức giải bài toán đốt cháy amin
Công thức bài toán đốt cháy amino axit
Công thức tính số mol OH- trong bài toán thủy phân peptit
Công thức tính số mắt xích (hệ số polime hóa) polime
Công thức tính lượng chất thu được ở điện cực
Công thức tính bài toán nhiệt nhôm
Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm
Công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat)
Công thức khử oxit sắt bằng CO và H2