Với Công thức phản ứng xà phòng hóa este Hoá học lớp 12 chi tiết nhất giúp học sinh dễ dàng nhớ toàn bộ các công thức phản ứng xà phòng hóa este từ đó biết cách làm bài tập Hoá học 12. Mời các bạn đón xem:
Công thức phản ứng xà phòng hóa este hay nhất – Hoá học lớp 12
Bài tập về phản ứng xà phòng hóa este rất phổ biến trong các đề thi, đề kiểm tra. Nó cũng chiếm phần lớn số lượng so với các dạng bài tập khác và trải đều ở các mức độ (thông hiểu - vận dụng - vận dụng cao). Bài viết này sẽ giúp các em nắm rõ và thật tự tin khi giải các bài tập thủy phân este.
1. Công thức giải bài toán phản ứng xà phòng hóa este
a) Xà phòng hóa este đơn chức, mạch hở
- Tổng quát:
→ nRCOOR’ p/ư = nNaOH p/ư = nRCOONa = nR’OH
- Một số công thức áp dụng:
+ Theo định luật bảo toàn khối lượng:
meste + mNaOH = mmuối rắn + mR’OH
+ Theo định luật bảo toàn nguyên tố:
nOH (NaOH) = nOH (R’OH); nNa (NaOH) = nNa (RCOONa)
b) Xà phòng hóa este đa chức
- Este tạo thành từ axit đơn chức và ancol đa chức (n chức): (RCOO)nR’
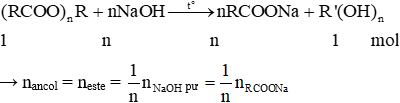
- Este tạo thành từ axit đa chức (n chức) và ancol đơn chức: R(COOR’)n
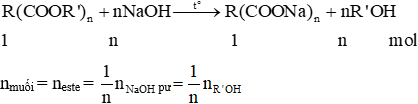
- Este tạo nên từ ancol và axit có thì m là số chức este và:
+ n-COO- = nNaOH
+ meste + mNaOH pư = mmuối rắn + mancol
c) Xà phòng hóa este của phenol
Tổng quát:
→ Nếu phản ứng vừa đủ:
- Định luật bảo toàn khối lượng:
meste + mNaOH pư = mmuối rắn + m
- Hỗn hợp este đơn chức có
→ Có một este của phenol.
Ví dụ: Cho 0,1 mol một este X tác dụng vừa đủ với dung dịch chứa 0,2 mol NaOH, thu được hỗn hợp hai muối của hai axit hữu cơ đều đơn chức và 6,2 g một ancol Y. Y là
A. propan-1,3-điol.
B. butan-1-ol.
C. propan-1-ol hay propan-2-ol.
D. etilenglicol.
Hướng dẫn giải
Theo đề bài sau phản ứng thu được hỗn hợp hai muối của hai axit hữu cơ đều đơn chức và ancol; lại có → este 2 chức tạo nên từ ancol 2 chức
→ nacol = neste = 0,1 mol
→ Mancol = (g/mol)
→ ancol Y là C2H4(OH)2 etylenglicol
→ Đáp án D
2. Bạn nên biết:
- Cô cạn dung dịch sau phản ứng được chất rắn khan, chú ý đến lượng NaOH còn dư hay không.
mrắn khan = mmuối + mNaOH (nếu có)
3. Kiến thức mở rộng
Este tạo thành từ axit đa chức (n chức) và ancol đa chức (m chức):
nmuối = (số chức ancol).neste
nancol = (số chức axit).neste
n-COO- = nNaOH = (số chức ancol).(số chức axit).neste
4. Bài tập minh họa
Câu 1: Thuỷ phân hoàn toàn 0,2 mol một este E cần dùng vừa đủ 100 gam dung dịch NaOH 24%, thu được một ancol và 43,6 gam hỗn hợp muối của hai axit cacboxylic đơn chức. Hai axit đó là
A. HCOOH và CH3COOH
B. CH3COOH và C2H5COOH
C. C2H5COOH và C3H7COOH
D. C3H7COOH và C4H9COOH
Hướng dẫn giải
nNaOH = 0,6 mol
Kết hợp đề bài → este 3 chức tạo bởi axit cacboxylic đơn chức và ancol 3 chức
→ n muối = n NaOH = 0,6 mol
Gọi công thức chung của hai muối là
→
→
→ 2 muối HCOONa và CH3COONa thỏa mãn
→ Đáp án A
Câu 2: Cho 0,1 mol phenyl axetat tác dụng hết với 300 ml dung dịch NaOH 1M. Kết thúc phản ứng, cô cạn dung dịch thì khối lượng chất rắn khan thu được là
A. 16,2 gam.
B. 22,0 gam.
C. 19,8 gam.
D. 23,8 gam.
Hướng dẫn giải
nNaOH = 0,3 mol
Áp dụng định luật bảo toàn khối lượng:
meste + mNaOH = m rắn + m
136.0,1 + 40.0,3 = m rắn + 18.0,1
→ m rắn = 23,8 gam
→ Đáp án D
Xem thêm các công thức Hoá học lớp 12 đầy đủ, chi tiết khác:
Công thức tính hiệu suất phản ứng este hóa
Công thức phản ứng xà phòng hóa este
Công thức phản ứng xà phòng hóa chất béo
Công thức bài toán đốt cháy este
Công thức bài toán đốt cháy chất béo
Công thức tính số mắt xích tinh bột
Công thức tính số mắt xích xenlulozơ
Công thức tính nhanh số đồng phân amin, amino axit
Công thức giải bài toán đốt cháy amin
Công thức bài toán đốt cháy amino axit
Công thức tính số mol OH- trong bài toán thủy phân peptit
Công thức tính số mắt xích (hệ số polime hóa) polime
Công thức tính lượng chất thu được ở điện cực
Công thức tính bài toán nhiệt nhôm
Công thức tính nhanh số mol OH- hoặc số mol Al(OH)3 khi cho muối nhôm phản ứng với dung dịch kiềm
Công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat)
Công thức khử oxit sắt bằng CO và H2