Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học (Phần 7)
Lời giải:
Gọi % 121Sb là x (%), suy ra % 123Sb là 100 – x (%)
Giả sử có 1 mol Sb2O3
Lời giải:
1 tấn = 1000 kg = 1 000 000 gam
→mAl thực tế = 256,5. 90% = 230,85 (kg).
a. CH3COOH và NaOH;
b. H2S và Pb(NO3)2;
c. H2SO4 và BaCl2;
d. NaHCO3 và HCl;
e. NaHCO3 và NaOH;
f. NaCl và KCl;
g. (NH4)2CO3 và HCl;
h. CaCO3 và HCl.
Lời giải:
a. CH3COOH + NaOH → CH3COONa + H2O
b. H2S + Pb(NO3)2 → PbS↓ + 2HNO3
c. H2SO4 + BaCl2 → BaSO4 + 2HCl
d. NaHCO3 + HCl → NaCl + H2O + CO2↑
e. NaHCO3 + NaOH → Na2CO3 + H2O
f. Không xảy ra phản ứng;
g. (NH4)2CO3 + 2HCl → 2NH4Cl + H2O + CO2↑
h. CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Câu 4: (NH4)2SO4 làm quỳ tím hoá thành màu gì?
(NH4)2SO4 làm quỳ tím hoá thành màu đỏ vì (NH4)2SO4 có tính axit.
Câu 5: 0,5 lít dung dịch HCl có hòa tan 224 ml khí HCl ở đktc. Tính độ pH của HCl?
Lời giải
VHCl = 224 ml = 0,224 lít
A. HCOOCH2CH3;
B. HOCH2CH2CHO;
C. CH3CH2COOH;
D. CH3COOCH3.
Lời giải:
Đáp án đúng là: A
nNaOH = 0,3. 1 = 0,3 (mol)
Vì X phản ứng với NaOH theo tỉ lệ 1: 1 nên nNaOH phản ứng = nX = 0,2 (mol)
→nNaOH dư = 0,3 – 0,2 = 0,1 (mol) →mNaOH dư = 0,1. 40 = 4(g)
Nên khi cô cạn dung dịch sau phản ứng, thu được 17,6 gam chất rắn khan gồm NaOH dư và muối → mMuối = 17,6 – 4 = 13,6 (g)
→MMuối = → Công thức của muối là HCOONa
→ Với X có công thức phân tử C3H6O2 thì công thức của X là HCOOCH2CH3.
Lời giải:
1.
;
Với n là hoá trị cao nhất của X ()
Bảo toàn e ta có:
Với n = 3 thì Mx = 27 (g/mol) (Thoả mãn)
Vậy X là nhôm (Al).
2.
;
M có hoá trị là II nên ta có:
Bảo toàn e ta có:
Vậy M là đồng (Cu).
3.
;
M có hoá trị là III nên ta có:
Bảo toàn e ta có:
Vậy M là nhôm (Al).
A. Ca;
B. Ba;
C. Mg;
D. Al.
Lời giải:
Đáp án đúng là: B
Phương trình:
Theo phương trình:
→ y = 2; x = 2 (Thoả mãn) nên MM = 137 (g/mol)
Vậy M là bari (Ba).
Câu 9: Este E (no, mạch hở), phân tử có chứa 3 liên kết π. Công thức phân tử của E có dạng là:
A. CnH2n-4O2;
B. CnH2n-4O6;
C. CnH2n-2O2;
D. CnH2n-2O4;
Lời giải:
Đáp án đúng là: B
Vì este E no nên không có liên kết π ở gốc hiđrocacbon.
Mà phân tử có 3 liên kết π nên E sẽ có 3 chức este COO.
Vậy E no, ba chức.
Cách 1: E no, ba chức nên độ bất bão hoà k = 3. Vậy este: CnH2n-4O6.
Cách 2: Khái quát hoá:
(HCOO)3C3H5 → C6H8O6 → CnH2n-4O6.
a) 142 gam Cl2;
b) 41,1 gam H2SO4;
c) 9.1023 phân tử Na2CO3;
d) 16,8 lít khí CO2 (đktc).
Lời giải:
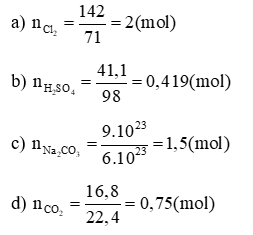
Câu 11: Cho 16,8 lít khí SO2 ở đktc. Tính:
a) số mol SO2
b) khối lượng SO2
c) số phân tử SO2
d) số nguyên tử oxi trong hợp chất SO2
Lời giải:
c) Số phân tử SO2 = 0,75. 6.1023 = 4,5.1023 phân tử
d) Số nguyên tử O trong hợp chất SO2 = 2. Số phân tử SO2 = 9.1023 nguyên tử.
A. S và Cl;
B. P và S;
C. Cl và Ar;
D. Si và P.
Lời giải:
Đáp án đúng là: A
Do X và Y liên tiếp trong bảng tuần hoàn → pY – pX = 1 (1)
Mà: (pX + eX ) + (pY + eY) = 66 → pX + pY = 33 (2)
Giải (1) và (2) ta được: pX = 16 (S); pY = 17 (Cl)
Vậy hai nguyên tố X và Y lần lượt là S và Cl.
Câu 13: Viết các công thức cấu tạo và gọi tên các hợp chất mạch hở có công thức phân tử: C3H5Cl?
Lời giải:
CH3 – CH = CH – Cl: 1 – cloprop – 1 – en
CH3 – CCl = CH2: 2 – cloprop – 1 – en
CH2Cl – CH = CH2: 3 – cloprop – 1 – en.
CH2Cl – CH = CH2: 3 – cloprop – 1 – en: x (mol; x > 0)
CH2 = CHCl: Vinylclorua: y (mol; y > 0)
Khi đốt cháy hoàn toàn hỗn hợp X thu được CO2 và HCl với tỉ lệ số mol tương ứng là 5/2 nên:
Lời giải:
Cho hỗn hợp vào dung dịch H2SO4 đặc nguội thì ta tách được nhôm vì Al bị thụ động bởi axit sunfuric đặc nguội, còn Cu bị hoà tan.
PTHH:
- Cho Mg vào dung dịch CuSO4 để thu được Cu.
PTHH: Mg + CuSO4 → MgSO4 + Cu.
Câu 16: Viết công thức cấu tạo các chất có tên gọi sau:
Lời giải:
a) CH3 – CH(CH3) – (CH3)C(C2H5) – CH2 – CH3
b) CH3 – C(CH3)2 – CH(CH3) – CH(CH3) – CH2 – CH2 – CH3
c) CH3 – C(CH3)2 – CH(CH3) – CH2 – CH2 – CH3.
Lời giải:
Xét
→ Sinh ra 2 muối
Bảo toàn Na: 2a + 3b = nNaOH = 0,25 (1)
Bảo toàn P:
Giải (1), (2), ta được: a = b = 0,05
Lời giải:
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; ZB = 25.
Cấu hình electron:
A: 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
a. Hòa tan 100 ml dung dịch HCl 1,4M vào nước 900ml;
b. Cho 200 ml dung dịch NaOH 0,01M vào 300 ml dung dịch KOH 0,04M;
c. Hòa tan 40 ml dung dịch HNO3 0,06M vào 10 ml dung dịch KOH 0,04M;
d. Hòa tan 30 ml KOH 0,2M vào 0,5 ml nước.
Lời giải:
a. nHCl = 1,4. 0,1 = 0,14 (mol)
b. nNaOH = 0,2. 0,01 = 0,002 (mol);
nKOH = 0,3. 0,04 = 0,012(mol)
c.
PTHH: HNO3 + KOH → KNO3 + H2O
Theo phương trình: phản ứng = nKOH = 0,0004 (mol)
→ dư = 0,0024 - 0,004 = 0,002 (mol)
d. nKOH = 0,03. 0,2 = 0,006 (mol)
Câu 20: Viết các phản ứng cho quá trình oxi hóa, quá trình khử và cân bằng các phản ứng sau:
a) Ag+ + Fe2+ → Ag + Fe3+
b) Cr3+ + Zn → Cr + Zn2+
c) CH4 + O2 → CO2 + H2O
d) MnO2 + Al → Mn + Al2O3
Lời giải:
a)
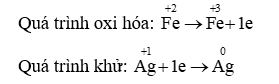
Phương trình hóa học: Ag+ + Fe2+ → Ag + Fe3+

d)
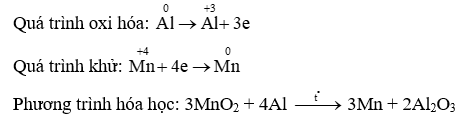
Câu 21: Ag2O + H2SO4 đặc, nóng →?
Lời giải:
Trường hợp dư oxit:
Trường hợp dư axit:
Câu 22: AgNO3 có đổi màu quỳ tím không?
Lời giải:
AgNO3 có đổi màu quỳ tím sang màu đỏ vì AgNO3 được tạo thành kim loại yếu và gốc axit mạnh.
Câu 23: AgNO3 tác dụng H2SO4 có hiện tượng gì?
AgNO3 tác dụng H2SO4 có hiện tượng: Xuất hiện kết tủa màu trắng.
2AgNO3 + H2SO4 → Ag2SO4↓ + 2HNO3
Câu 24: NaNO3 có tác dụng với AgNO3 không?
Lời giải:
NaNO3 không tác dụng với AgNO3 vì để phản ứng xảy ra trong dung dịch, sản phẩm cần thỏa mãn ít nhất một điều kiện sau:
- Có chất kết tủa.
- Có chất khí.
- Nước.
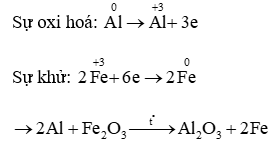
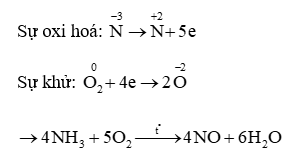
A. 58;
B. 86;
C. 64;
D. 32.
Lời giải:
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Tổng hệ số các chất (là số nguyên tối giản) sau khi phản ứng được cân bằng là 58.
Câu 27: Nhôm hiđroxit Al(OH)3 không bị hòa tan trong dung dịch nào sau đây?
A. dung dịch HCl;
B. dung dịch NaOH;
C. dung dịch NaHSO4;
D. dung dịch NH3.
Lời giải:
Đáp án đúng là: D
Nhôm hiđroxit Al(OH)3 không bị hòa tan trong dung dịch NH3.
Al(OH)3 bị hòa tan trong dung dịch HCl, NaOH và NaHSO4 theo phương trình:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
2Al(OH)3+ 6NaHSO4 → Al2(SO4)3 + 3Na2SO4 + 6H2O
Câu 28: Hoàn thành chuỗi phản ứng sau:
Lời giải:
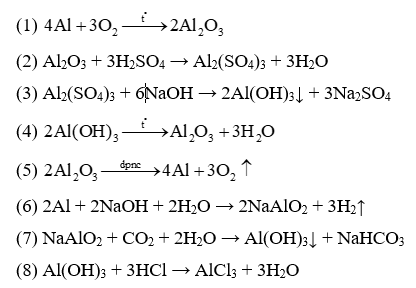
Câu 29: Hoàn thành dãy chuyển hoá:
Lời giải:
(1) 2Al + 6HCl → 2AlCl3 + 3H2↑
(2) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
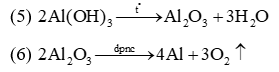
(3) Al(OH)3 + NaOH → NaAlO2 + 2H2O
(4) NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
Câu 30: Viết phương trình phản ứng dưới dạng ion, phân tử, ion thu gọn:
Al(OH)3 + NaOH →?
Lời giải:
Phương trình phân tử: Al(OH)3 + NaOH → NaAlO2 + 2H2O
Phương trình dưới dạng ion:
Phương trình ion thu gọn:
Câu 31: Al2O3 là oxit gì? Al2O3 có tan trong nước không?
Lời giải:
- Al2O3 là một oxit lưỡng tính nên vừa tác dụng với axit, vừa tác dụng với bazơ.
- Al2O3 không tan trong nước.
a) Tính khối lượng dung dịch HCl đã dùng.
b) Cho 11,6 gam hỗn hợp X trên vào dung dịch CuSO4 dư. Tính khối lượng chất rắn thu được sau khi phản ứng kết thúc.
Lời giải
a)
Phương trình:

Theo phương trình (1), (2), ta có:
b) Cho 11,6 gam hỗn hợp X trên vào dung dịch CuSO4 dư thì chỉ xảy ra phương trình: Zn + CuSO4 → ZnSO4 + Cu (3)
Vậy chất rắn thu được gồm Cu và Al2O3.
Theo phương trình (3): nCu = nZn = 0,1 (mol)
→mchất rắn = mCu + = 0,1. 64 + 5,1 = 11,5 (g)
Vậy khối lượng chất rắn thu được sau khi phản ứng kết thúc là 11,5 gam.
Câu 39: Theo thuyết axit – bazơ của Bronstet, ion Al3+ trong nước có tính chất:
A. axit;
B. lưỡng tính;
C. bazơ;
D. trung tính.
Lời giải:
Đáp án đúng là: A
Nên Al3+ có tính axit.
Lời giải:
Cho NaOH dư vào:
+ Các chất không có hiện tượng là: NaCl, NaNO3 (1)
+ Các chất xuất hiện kết tủa trắng là: MgCl2, Mg(NO3)2 (2)
+ Các chất xuất hiện kết tủa keo trắng, sau đó tan dần đến hết là: Al(NO3)3, AlCl3 (3)
+ Các chất xuất hiện kết tủa xanh lam là: Cu(NO3)2, CuCl2 (4)
Cho nhóm (1) vào dd AgNO3:
+ Xuất hiện kết tủa trắng là NaCl (nhận ra)
+ Không hiện tượng NaNO3 (nhận ra)
Cho nhóm (2) vào dd AgNO3:
+ Xuất hiện kết tủa trắng là MgCl2 (nhận ra)
+ Không hiện tượng Mg(NO3)2 (nhận ra)
Cho nhóm (3) vào dd AgNO3:
+ Xuất hiện kết tủa trắng là AlCl3 (nhận ra)
+ Không hiện tượng Al(NO3)3 (nhận ra)
Cho nhóm (4) vào dd AgNO3:
+ Xuất hiện kết tủa trắng là CuCl2 (nhận ra)
+ Không hiện tượng Cu(NO3)2 (nhận ra).
Câu 35: Tại sao Al(NO3)3 không tác dụng với HCl?
Lời giải:
Al(NO3)3 không tác dụng với HCl vì không thoả mãn điều kiện xảy ra phản ứng trao đổi là có chất khí, chất kết tủa, nước hay chất điện li yếu tạo thành.
Lời giải:
Mg(OH)2 là bazơ nên trung hoà axit clohidric trong dạ dày
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Câu 37: Axit H2SO4 loãng có thể tác dụng với dãy các chất nào sau đây:
A. CaO, Cu, KOH, Fe;
B. CaO, SO2, K, Fe(OH)3;
C. CaO, Zn, NaOH, ZnO;
D. CaO, FeO, Ag, KOH;
Lời giải:
Đáp án đúng là: C
Đáp án A sai vì có Cu không tác dụng với H2SO4 loãng
Đáp án B sai vì có SO2 không tác dụng với H2SO4 loãng
Đáp án D sai vì có Ag không tác dụng với H2SO4 loãng
Axit H2SO4 loãng có thể tác dụng với dãy các chất CaO, Zn, NaOH, ZnO, Fe, KOH, Fe(OH)3, K, FeO,…
Câu 38: Viết phương trình dạng phân tử và ion rút gọn khi cho:
Lời giải:
a) Ba(HCO3)2 + 2HNO3 → Ba(NO3)2 + 2H2O + 2CO2↑
Ba(HCO3)2 + Ca(OH)2 → BaCO3↓ + CaCO3↓ + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4↓ + 2NaHCO3
Ba(HCO3)2 + 2NaHSO4 → BaSO4↓ + 2Na2SO4 + CO2↑ + 2H2O
b) Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
3Na2CO3 + 2FeCl3 + 3H2O → 6NaCl + 2Fe(OH)3↓ + 3CO2↑
3Na2CO3 + 2AlCl3 + 3H2O → 6NaCl + 2Al(OH)3↓ + 3CO2↑
Na2CO3 + 2HCl → 2NaCl +CO2 + H2O
c) 2NaHCO3 + H2SO4 → Na2SO4 + CO2 + 2H2O
2NaHCO3 + 2KOH → Na2CO3 + K2CO3 + 2H2O
NaHCO3 + Ba(OH)2 → BaCO3 + NaOH + H2O
Câu 39: Ba3(PO4)2 kết tủa màu trắng hay vàng?
Lời giải:
Ba3(PO4)2 kết tủa màu trắng, được tạo ra theo phương trình sau:
Câu 40: Tại sao KHCO3 không phản ứng với BaCl2?
Lời giải:
Điều kiện của phản ứng giữa muối với muối là: Các chất tham gia phản ứng phải tan. Sản phẩm tạo thành phải có ít nhất 1 chất kết tủa.
KHCO3 và BaCl2 là những chất tan. Đây là điều kiện cần để phản ứng giữa muối với muối xảy ra. Tiếp theo ta xét chất sản phẩm đó là Ba(HCO3)2 và KCl, 2 chất này đều tan. Việc này không thỏa mãn điều kiện của phản ứng giữa muối với muối nên xem như phản ứng của KHCO3 vs BaCl2 không xảy ra.
Câu 41: BaCl2 có tác dụng với HCl không?
Lời giải:
BaCl2 không tác dụng với HCl do sản phẩm tạo ra không thoả mãn điều kiện của phản ứng trao đổi.
Điều kiện xảy ra phản ứng trao đổi:
- Tạo kết tủa hoặc chất bay hơi
- Tạo chất điện li yếu (nước, axit yếu).