Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học (Phần 3)
Câu 1: AgNO3+ Na2SO4ra hiện tượng gì?
Lời giải:
Phương trình phản ứng:
Na2SO4 + 2AgNO3 → Ag2SO4↓trắng + 2NaNO3
Hiện tượng: Xuất hiện kết tủa màu trắng.
Câu 2: Tính pH của dung dịch NH4Cl 0,1M biết
Lời giải:
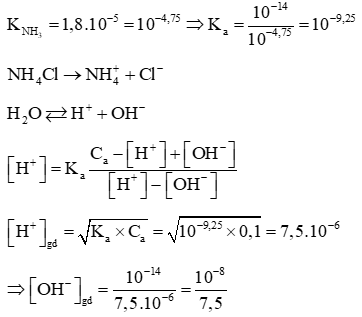
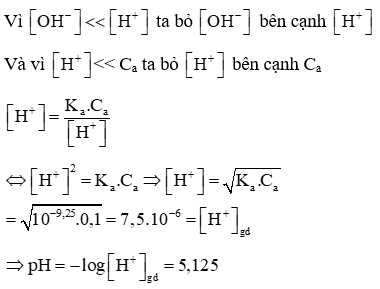
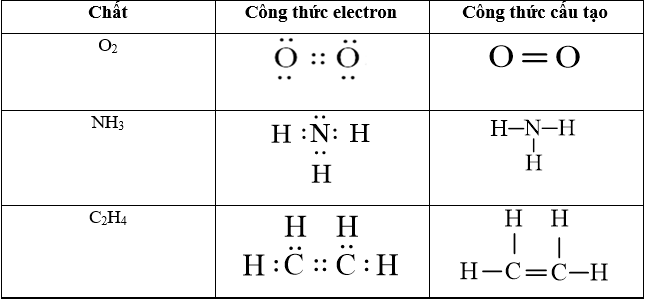
Câu 3: Viết công thức electron và công thức cấu tạo của các phân tử sau: O2, NH3, C2H4.
Lời giải:
A. FeO;
B. Fe3O4;
C. Fe2O3;
D. Tất cả đều sai.
Lời giải:
Đáp án đúng là: B
Vì H2SO4 đặc nóng dư nên khí A sinh ra là SO2.
Muối khan thu được là: Fe2(SO4)3
Theo bảo toàn nguyên tố Fe có:
Vì dung dịch NaOH dư nên khi dẫn SO2 vào đung dịch NaOH chỉ xảy ra một phản ứng:
2NaOH + SO2 → Na2SO3 + H2O
Coi oxit FexOy ban đầu là hỗn hợp của Fe và O.
Gọi nO = a (mol)
Áp dụng định luật bảo toàn mol electron, ta có:
Có: → Oxit cần tìm là Fe3O4.
Lời giải:
Lấy mẫu các dung dịch rồi tiến hành đun nóng:
- Xuất hiện kết tủa trắng, có bọt khí → Mg(HCO3)2 hoặc Ba(HCO3)2 (Nhóm I)
- Xuất hiện bọt khí là KHCO3
- Không xảy ra hiện tượng gì là NaHSO4 hoặc Na2CO3 (Nhóm II)
Dùng KHCO3 nhận biết các chất trong nhóm II:
- Xuất hiện bọt khí là NaHSO4
2KHCO3 + 2NaHSO4 → K2SO4 + Na2SO4 + 2CO2↑ + 2H2O
- Không có hiện tượng gì là Na2CO3
Dùng NaHSO4 nhận biết các chất trong nhóm I:
- Xuất hiện kết tủa trắng và bọt khí là Ba(HCO3)2
Ba(HCO3)2 + 2NaHSO4 → BaSO4↓ + Na2SO4 + 2CO2 ↑ + 2H2O
- Xuất hiện bọt khí là Mg(HCO3)2
Mg(HCO3)2 + 2NaHSO4 → MgSO4 + Na2SO4 + 2CO2 ↑ + 2H2O
Lời giải:
- Ở 90 oC: Trong 150 gam dung dịch A có 50 gam A
Vậy trong 600 gam dung dịch A có: A
Giả sử khi làm lạnh từ 90 oC xuống 10 oC có m gam chất rắn A tách ra
- Ở 10 oC: Trong 115 gam dung dịch A có 15 gam A
Vậy trong (600 - m) gam dung dịch A có (200 - m) gam A
⇒(600 - m). 15 = (200 - m). 115
⇒ m = 140 (gam)
Vậy khi làm lạnh 600 gam dung dịch bão hòa A ở 90 oC xuống 10 oC thì có 140 gam chất rắn A tách ra.
A. pentapeptit;
B. tripeptit;
C. tetrapeptit;
D. đipeptit.
Lời giải:
Đáp án đúng là: C
Đặt công thức chung của 2 amino axit là CmH2m+1O2N; Giả sử X tạo bởi k gốc amino axit → X có dạng

(1) Fe3O4 + 4H2SO4 (loãng) → FeSO4 + Fe2(SO4)3 + 4H2O
(2) 3Fe + 4H2O Fe3O4 + 4H2
(3) Fe(NO3)2 + HCl → FeCl3 + NO + H2O
(4) FeS + H2SO4 (đặc nóng) → Fe2(SO4)3 + H2S + H2O
Có bao nhiêu phản ứng viết đúng?
A. 1;
B. 2;
C. 3;
D. 4.
Lời giải:
Đáp án đúng là: B
Các phản ứng (1) và (2) đúng.
(3) Sai vì: 9Fe(NO3)2 + 12HCl → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
(4) Sai vì: 2FeS + 10H2SO4 (đặc, nóng) → Fe2(SO4)3 + 9SO2 + 10H2O
A. 11,2;
B. 6,72;
C. 13,44;
D. 8,96.
Lời giải:
Đáp án đúng là: C
Xét 11g A:
Bảo toàn electron: ne = 2nH2 = 0,8 mol = 2nFe + 3nAl (1)
Và mFe + mAl = 11g nên 56nFe + 27nAl = 11 (2)
Từ (1) và (2) giải hệ phương trình được: nFe = 0,1 mol; nAl = 0,2 mol.
Trong 22g A có: nFe = 0,2 mol; nAl = 0,4 mol
Bảo toàn electron: 3nFe + 3nAl = 3nNO Þ nNO = 0,6 mol.
VNO = 0,6. 22,4 = 13,44 lít.
Câu 10: Viết phương trình điện li của các chất sau: (CH3COO)2Cu, HBrO4, K2CrO4, HCOOH, Mg(NO3)2?
Lời giải:
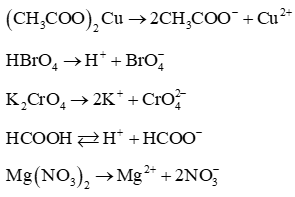
Lời giải:
X được tạo nên từ hạt Aa+ có cấu hình e là 1s22s22p63s23p6.
A có (18 + a) electron.
X được tạo nên từ hạt Bb- có cấu hình e là 1s22s22p63s23p6
B có (18 - b) electron.
X có dạng AbBa
Gọi số hạt proton, nơtron trong A, B lần lượt là pA, pB, nA, nB
Trong đó pA = eA; pB = eB.
Tổng số hạt trong X là: b.(2pA + nA) + a.(2pB + nB) = 164
Mà
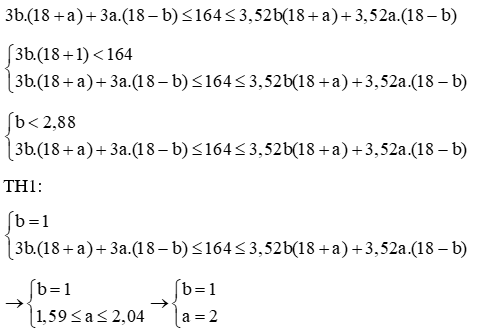
Vậy A có 20 electron, A là canxi (Ca)
B có 17 electron, B là clo (Cl)
Vậy X là CaCl2
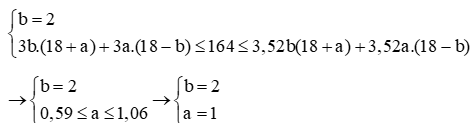
Vậy A có 19 electron, A là kali (K)
B có 16 electron, B là lưu huỳnh (S)
Vậy X là K2S.
Lời giải:
+) Trong phân tử MX2 có tổng số hạt p n e bằng 164 hạt
→2PM + NM + 2(2PX + NX) = 164 (1)
+) Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52
→2PM + 2.2PX − (NM + 2NX) = 52 (2)
Từ (1) và (2) ta có: PM + 2PX = 54 (*)
+) Số khối của nguyên tử M lớn hơn số khối của nguyên tử X là 5
→PM + NM − (PX + NX) = 5 (3)
+) Tổng số hạt p, n, e trong M lớn hơn trong X là 8
→2PM + NM − (2PX + NX) = 8 (4)
Từ (3) và (4) có PM – PX = 3 (**)
Từ (*), (**) giải hệ phương trình ta được: PM = 20; PX = 17;
Vậy M là Canxi (Ca).
A. 30%;
B. 50%;
C. 60%;
D. 75%.
Lời giải:
Đáp án đúng là: C
0,75 1,5 (mol)
Giả sử H = 100% → axit hết;
neste = naxit = 0,75 mol
→ meste lý thuyết = 0,75.88 = 66 gam
Hiệu suất phản ứng là: .
Lời giải
Dung dịch HCl pH = 1 có
Dung dịch HCl pH = 2 có
Khi trộn 2 dung dịch thu được dung dịch mới có
Thể tích dung dịch mới là V1 + V2 (lít)
→
Dung dịch mới có pH = 1,26
→ .
A. CuSO4;
B. Cu(NO3)2;
C. CuSO4, Cu(NO3)2;
D. CuSO4, CuCl2, Cu(NO3)2.
Lời giải:
Đáp án đúng là: C
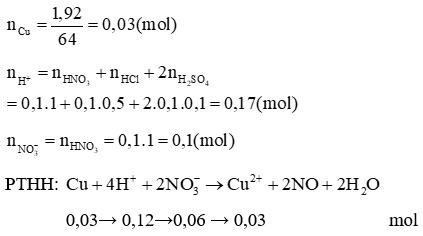
Vậy dung dịch sau phản ứng chứa: 0,04 mol , 0,03 mol Cu2+, 0,05 mol Cl-, 0,01 mol , 0,05 mol H+. Do axit HCl dễ bay hơi khi cô cạn nên cô cạn dung dịch sau phản ứng thu được muối Cu(NO3)2 0,02 mol và CuSO4 0,01 mol.
A. 405;
B. 406;
C. 403;
D. 428.
Lời giải:
Đáp án đúng là: B
Gọi x và 1 – x lần lượt là tỉ lệ số nguyên tử của 10B và 11B
→ 10x + 11.(1 – x) = 10,812 → x = 0,188
Tỉ lệ:
Vậy nếu có 94 nguyên tử 10B thì có nguyên tử 11B.
Lời giải:
Đặt x, y lần lượt là số mol Fe và Mg.
Ta có các quá trình:
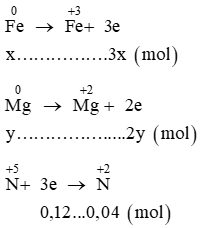
Áp dụng định luật bảo toàn electron ta có: 3x + 2y = 0,12 (1)
Mặt khác khối lượng hỗn hợp: mhỗn hợp = 56x + 24y = 1,84 (2)
Từ (1) và (2) suy ra x = 0,02; y = 0,03.
A. 1,792 lít;
B. 2 lít;
C. 3 lít;
D. 1,344 lít.
Lời giải:
Đáp án đúng là: A
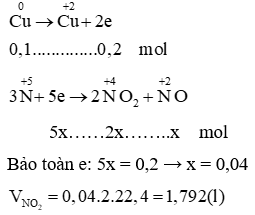
Lời giải:
- Trích mẫu thử.
- Cho Fe vào các mẫu thử.
+ Mẫu thử nào tạo khí không màu là HCl
Fe + 2HCl → FeCl2 + H2↑
+ 3 mẫu thử còn lại không có hiện tượng gì.
- Cho đồng thời Fe và HCl vừa nhận được vào các mẫu thử còn lại
+ Mẫu thử nào tạo khí không màu hóa nâu trong không khí là NaNO3
Fe + 4HCl + NaNO3 → FeCl3 + NaCl + NO + 2H2O
+ 2 mẫu thử còn lại không có hiện tượng gì.
- Cô cạn hai mẫu thử còn lại:
- Mẫu thử không thu được chất rắn sau khi cô cạn là H2O.
- Mẫu thử nào thu được chất rắn khan là NaCl.
Lời giải:
Câu 21: Viết phương trình phản ứng để chứng minh
a) N2 vừa có tính oxi hoá, vừa có tính khử.
Lời giải:
a)
Số oxi hoá của N từ 0 lên + 2 → N2 có tính khử.
N2 + 6Li → 2Li3N
Số oxi hoá của N từ 0 xuống -3 → N2 có tính oxi hoá.
b) 2NH3 + 3CuO 3Cu + 3H2O + N2
Số oxi hoá của N từ -3 lên + 0 → NH3 có tính khử.
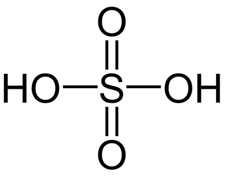
Câu 22: Công thức cấu tạo của H2SO4?
Lời giải:
Công thức cấu tạo của H2SO4 là:
Câu 23: Cách nhận biết một bình khí NH3 đầy?
A. Dùng dung dịch Ba(OH)2 cho vào bình NH3;
B. Dùng quỳ tím ẩm để cạnh miệng;
C. Dùng dung dịch phenolphtalein cho vào bình;
D. Dùng que đóm còn tàn đỏ để cạnh miệng bình.
Lời giải:
Đáp án đúng là: B
Cách nhận biết một bình khí NH3 đầy dùng quỳ tím ẩm để cạnh miệng bình.
Hiện tượng: Quỳ tím ẩm chuyển sang màu xanh.
a) Nước hàng (nước màu) được nấu từ đường sucrose (chiết xuất từ cây mía đường, cây thốt nốt, củ cải đường. ...) và nước.
b) Thạch găng được làm từ lá găng rừng, nước đun sôi, đường mía.
c) Kim loại được sản xuất từ nguồn nguyên liệu ban đầu là các quặng kim loại.
d) Gỗ thu hoạch từ rừng được sử dụng để đóng bàn ghế, giường tủ, nhà cửa.
Lời giải:
a, Vật thể tự nhiên: đường sucrose, cây mía đường, cây thốt nốt, củ cải đường, nước.
Vật thể nhân tạo: nước hàng (nước màu).
Vật vô sinh: nước, đường, nước hàng (nước màu).
Vật hữu sinh: cây mía đường, cây thốt nốt, cây củ cải đường.
b, Vật thể tự nhiên: lá găng rừng, nước, đường mía.
Vật thể nhân tạo: thạch găng.
Vật hữu sinh: lá găng rừng.
Vật vô sinh: nước, đường mía, thạch găng.
c, Vật thể tự nhiên: quặng kim loại.
Vật thể nhân tạo: kim loại.
Vật vô sinh: kim loại, quặng.
d, Vật thể tự nhiên: gỗ, rừng.
Vật thể nhân tạo: bàn ghế, giường tủ, nhà cửa.
Vật vô sinh: gỗ hạ từ cây, bàn ghế, giường tử, nhà cửa.
Vật hữu sinh: rừng.
Câu 25: Chất nào sau đây được gọi là đơn chất?
A. KClO3;
B. O3;
C. H2O;
D. H2SO4.
Lời giải:
Đáp án đúng là: B
O3 là đơn chất vì chất tạo nên từ 1 nguyên tố hoá học.
Câu 26: Làm thế nào để tách được khí CO2 và O2 thành từng chất riêng biệt?
Lời giải:
Dẫn hỗn hợp qua dung dịch Ca(OH)2 dư:
- CO2 phản ứng giữ lại
- O2 tinh khiết bay ra
Lọc lấy kết tủa cho phản ứng với dung dịch HCl dư thu được CO2.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Câu 27: Nung nóng BaSO4 trong không khí thu được những chất gì?
Lời giải:
Lời giải:
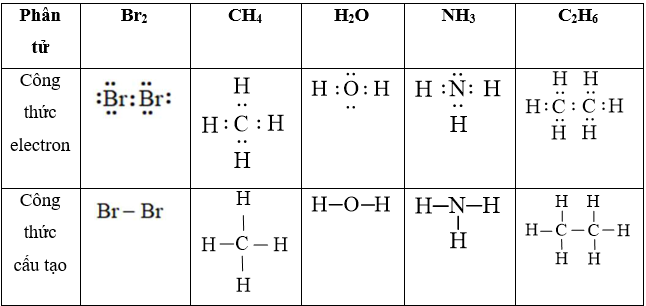
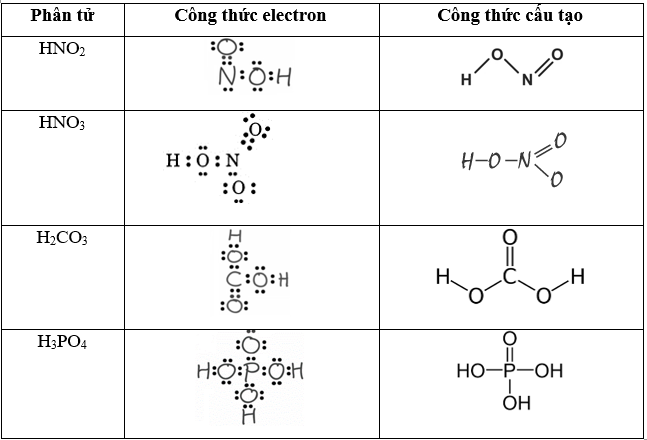
Câu 29: Viết công thức electron và công thức cấu tạo của các phân tử HNO2, HNO3, H2CO3, H3PO4?
Lời giải:
Câu 30:Cân bằng các phương trình hoá học sau:
b) Al2(SO4)3 + Ca(OH)2 → Al(OH)3 + CaSO4
Lời giải:
a)
Cách cân bằng: Theo phương pháp thăng bằng electron:

b) Al2(SO4)3 + 3Ca(OH)2 → 2Al(OH)3 + 3CaSO4
Cách cân bằng: nhẩm đại số.
Lời giải:
Vì A thuộc nhóm IA nên A hóa trị I trong hợp chất.
2A + 2H2O → 2AOH + H2
Theo PTHH ta có:
Vậy A là kali (K).
Câu 32: Ngâm một dây đồng vào dung dịch bạc nitrat, hiện tượng quan sát được là:
A. Một phần dây đồng bị hoà tan, có chất rắn màu xám bám ngoài dây đồng và dung dịch không màu chuyển dần sang màu xanh;
B. Không có hiện tượng nào xảy ra;
C. Kim loại bạc màu xám bám vào dây đồng, dây đồng không có thay đổi;
D. Không có chất mới nào sinh ra, chỉ có một phần dây đồng bị hoà tan.
Lời giải
Đáp án đúng là: A
Một phần dây đồng bị hoà tan, có chất rắn màu xám bám ngoài dây đồng và dung dịch không màu chuyển dần sang màu xanh;
Phương trình hoá học minh hoạ:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
A. 3;
B. 4;
C. 5;
D. 6.
Lời giải:
Đáp án đúng là: B
Các đơn chất là: Cl2, Fe, F2, Hg.
Lời giải:
Hợp chất A có phân tử gồm 1 nguyên tử của nguyên tố X kết hợp với 2 nguyên tử O nên A có CTHH dạng XO2
Ta có:
Vậy X là cacbon (C) nên CTHH của A là CO2.
A. CH4;
B. C2H4;
C. C4H8;
D. C4H10.
Lời giải:
Đáp án đúng là: D
Đặt công thức hợp chất Y là CxHy có phân tử khối MY.
%C = 82,76% ⇒ %H = 100% − 82,76% = 17,24%
Vì khối lượng mỗi nguyên tố tỉ lệ với thành phần phần trăm khối lượng của nó.
Ta có:
Công thức của Y là C4H10.
A. Fe;
B. Cu;
C. Ag;
D. Hg.
Lời giải:
Đáp án đúng là: C
Vậy X là bạc (Ag).
Câu 37: Nguyên tử Fe có hóa trị II trong công thức nào:
A. FeO;
B. Fe2O3;
C. Fe;
D. FeCl3.
Lời giải:
Đáp án đúng là: A
Trong hợp chất FeO, nguyên tử Fe có hoá trị II.
Câu 38: Cách viết nào sau đây chỉ 2 phân tử oxi?
A. 2O2;
B. 2O;
C. O4;
D. 4O.
Lời giải:
Đáp án đúng là: A
2 phân tử oxi được viết là: 2O2
A. X2Y3;
B. XY2;
C. X3Y2;
D. X2Y.
Lời giải:
Đáp án đúng là: C
Ta có:
+ XCl2 → X có hóa trị II
+ Y2O3 → Y có hóa trị III
Vậy công thức hóa học đúng là: X3Y2.
Lời giải:
Hai phân tử oxi: 2 O2.
Năm phân tử nước: 5 H2O.
Ba phân tử khí cacbonic: 3 CO2.
Sáu phân tử hiđro: 6 H2.
Câu 41: Nguyên tử cacbon có khối lượng 1,9926.10-23 gam. Khối lượng tính bằng gam của Ca?
Lời giải:
Nguyên tử cacbon có nguyên tử khối là 12 đvC.
Khối lượng của 1 đvC là:
Mà nguyên tử canxi có nguyên tử khối là 40 đvC.
Khối lượng của nguyên tử canxi là: .