Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (Phần 15)
Lời giải
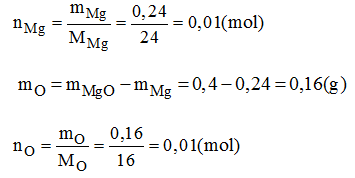
Vậy trong 1 phân tử hợp chất có 0,01 mol nguyên tử Mg; 0,01 mol nguyên tử O. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử O.
→ Công thức hóa học đơn giản của magie oxit là: MgO.
A. CH2 = CH2;
B. (CH3)2C = C(CH3)2;
C. CH2 = C(CH3)2;
D. CH3CH = CHCH3.
Lời giải
Đáp án đúng là: D
Đặt CTPT của anken là CnH2n (n ≥ 2)
Ta có: . Vậy anken có CTPT là C4H8.
Cho A tác dụng với dung dịch HBr chỉ cho một sản phẩm duy nhất nên A là CH3CH = CHCH3.
A. C2H4 và C3H6;
B. C3H6 và C4H8;
C. C2H6 và C3H8;
D. C3H8 và C4H10.
Lời giải
Đáp án đúng là: B
Nếu hiđrocacbon là ankan:
Vankan + Vamin = → Loại
Nếu hiđrocacbon là anken CnH2n
Bảo toàn nguyên tố H: 50.9 + 50.2n = 2 = 2.400 = 800 → n = 3,5
Vậy hai anken là C3H6 và C4H8.
Lời giải
Phương trình phản ứng:
Theo phương trình:
Câu 5: Đốt cháy hoàn toàn 13,5 gam etylamin, thu được H2O, N2 và x mol CO2. Giá trị của x là:
A. 0,6;
B. 0,3;
C. 0,4;
D. 0,2.
Lời giải
Đáp án đúng là: A
Bảo toàn nguyên tố C: C2H5NH2 → 2CO2
→ x = 0,3.2 = 0,6 (mol).
Câu 6: Đốt hoàn toàn 2,24 lít khí H2 (đktc) trong không khí, tính khối lượng nước thu được?
Lời giải
PTHH:
A. C2H3O2Na;
B. C2H5O2Na;
C. C3H5O2Na;
D. C3H7O2Na.
Lời giải
Đáp án đúng là: A
Vì sản phẩm cháy gồm Na2CO3, CO2 và H2O nên trong A chắc chắn có C, H, Na, có thể có O.
Ta có:
→ nNa = 0,05 (mol)
Vì trong A chỉ có một nguyên tử Na → nA = 0,05 mol
Gọi công thức phân tử của A là CxHyOzNa
Vậy CTPT của A là C2H3O2Na.
A. Fe;
B. Al;
C. Cr;
D. Mg.
Lời giải
Đáp án đúng là: C
PTHH:
Vậy R là crom (Cr).
Câu 9: Đốt cháy hoàn toàn 4,48 lít C3H8 (đktc) thu được V lít CO2 (đktc) và m gam nước. Tính m và V.
A. m = 14,4 gam, V = 13,44 lít;
B. m = 13,4 gam, V = 13,44 lít;
C. m = 13,44 gam, V = 14,4 lít;
D. m = 13,54 gam, V = 14,4 lít.
Lời giải
Đáp án đúng là: C
m = 0,8.18 = 14,4 gam
V = 0,6.22,4 = 13,44 lít.
Lời giải
Gọi n là hoá trị của M (n∈N*)
M2On + 2nHNO3 → 2M(NO3)n + nH2O
Gọi số mol của MS là x
Bảo toàn khối lượng:
mdd muối =
Ta có:
Thay giá trị của n = 1; 2; 3 thoả mãn n = 3 suy ra MM = 56 g/mol suy ra M là sắt (Fe).
mdd muối = 29 gam (thay M;n;x)
→ mdd sau khi tách = 29 – 8,08 = 20,92 (g)
→ còn lại = 34,7%.20,92 = 7,26 (g)
→ còn = 0,03 (mol)
→ tách ra = 0,05 – 0,03 = 0,02 (mol)
Rắn có dạng Fe(NO3)3.bH2O → = 0,02 (mol)
A. C2H7O.
B. C2H7N.
C. C3H9O2N.
D. C4H10N2O3.
Lời giải
mdd giảm =
Xét 6,75 gam A phản ứng tạo 0,075 mol N2
→ Vậy 4,5 gam A thì tạo 0,05 mol N2
→ nN(A) = 0,1 mol
Ta có : mA = mC + mH + mO + mN → nO = 0
→ nC : nH : nN = 0,2 : 0,7 : 0,1 = 2 : 7 : 1
→ CTĐG nhất và cũng là CTPT của A là C2H7N.
Câu 12: Đốt cháy hết 48 gam lưu huỳnh (S) trong oxi (O2) thu được 96 gam lưu huỳnh đioxit (SO2).
a, Viết công thức về khối lượng của phản ứng đã xảy ra
b, Tính khối lượng oxi đã phản ứng.
Lời giải
a. Phương trình:
Áp dụng định luật bảo toàn khối lượng:
b. Thay vào trên, ta có:
48 + = 96
→ = 96 – 48 = 48 (g).
Câu 13: Đốt cháy hoàn toàn 5,1 gam một este X cần vừa đủ 7,28 lít O2 (đktc). CTPT của X là:
A. C3H6O2;
B. C2H4O2;
C. C4H8O2;
D. C5H10O2.
Lời giải
Đáp án đúng là: D
Đặt công thức của este là CnH2nO2
Vậy CTPT của X là C5H10O2.
A. C2H6O;
B. C3H8O;
C. C2H4O2;
D. C4H10O.
Lời giải
Đáp án đúng là: C
Gọi công thức phân tử của Y có dạng: CxHyOz
Ta có x : y : z = nC : nH : nO = 0,2 : 0,4 : 0,2 = 1 : 2 : 1
Vậy công thức đơn giản nhất của Y là: (CH2O)n
Có MY = 60 (g/mol) → 30.n = 60 → n = 2.
Vậy công thức phân tử của Y là: C2H4O2.
A. CH4 và C2H4;
B. C2H6 và C3H6;
C. C2H6 và C2H4;
D. CH4 và C3H6.
Lời giải
Đáp án đúng là: A
Đặt công thức phân tử của ankan X là CnH2n+2, công thức phân tử của anken Y là CmH2m (điều kiện n≥1, m≥2)
Bảo toàn nguyên tố C ta có:
Suy ra n + 2m =5
Vì n≥1, m≥2 nên chỉ có n = 1, m = 2 thỏa mãn. Vậy X là CH4 và Y là C2H4.
a) Viết phương trình hoá học của các phản ứng xảy ra?
b) Tính khối lượng dung dịch NaOH đã dùng?
c) Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng?
Lời giải
a) Phương trình phản ứng:
4P + 5O2 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
b)
→
Theo phương trình:
Khối lượng NaOH = 0,4.40 = 16 g
Khối lượng dung dịch NaOH
Theo phương trình:
Theo định luật bảo toàn khối lượng:
Lời giải
Bảo toàn nguyên tố C:
Khối lượng bình tăng:
Bảo toàn nguyên tố H:
mC + mH = 0,3.12 + 0,6 = 4,2 < mX
Vậy trong X có O
Tỉ lệ: nC : nH : nO = 0,3 : 0,6 : 0,3 = 3 : 6 : 3 = 1 : 2 : 1
Vậy công thức đơn giản nhất là CH2O.
Lời giải
P tính theo sản phẩm P2O5, O2 còn dư
→ mP = 0,4.31 = 12,4 (g).
A. Anken.
B. Ankan.
C. Ankadien.
D. Ankin.
Lời giải
Đáp án đúng là: B
Có → ankan.
Câu 20: Đốt cháy hoàn toàn hỗn hợp khí A chứa CO và H2 cần dùng vừa đủ 5,6 lít khí oxi và sản phẩm tạo thành chứa 3,36 lít khí cacbonic. Các khí ở đktc.
a) Lập các phương trình hóa học
b) Tính thể tích mỗi khí trong hỗn hợp A.
c) Tính % thể tích mỗi khí trong hỗn hợp A.
Lời giải
a.
b. Theo phương trình:
c.
A. 1,12;
B. 1,344;
C. 1,68;
D. 1,792.
Lời giải
Đáp án đúng là: C
Ta thấy hỗn hợp X đều chứa ancol no, đơn chức nên gọi CTTQ của X là CnH2n+1OH.
Có
Theo phương trình, ta có:
Theo phương trình, ta có:
Theo phương trình, ta có:
Câu 22: Đốt cháy hoàn toàn m gam một amin X bằng lượng không khí vừa đủ thu được 17,6 gam CO2 và 12,6 gam H2O và 69,44 lít nitơ. Giả thiết không khí chỉ gồm nitơ và oxi, trong đó oxi chiếm 20% thể tích. Các thể tích đo ở đktc. Amin X có công thức phân tử là:
A. C2H5NH2;
B. C3H7NH2;
C. CH3NH2;
D. C4H9NH2.
Lời giải
Đáp án đúng là: A
Nhận thấy đáp án đều là các amin no đơn chức mạch hở nên ta tính ngay được số mol amin bằng việc áp dụng công thức tính nhanh:
→ mamin = mC + mH + mN = 0,4.12 + 0,7.2 + 0,2.14 = 9 (g)
Lời giải
Amin no, đơn chức, mạch hở có công thức tổng quát là CnH2n+3N (n≥1)
Tỉ lệ khối lượng của CO2 với H2O là 44 : 27 nên coi khối lượng của CO2 là 44 gam, khối lượng của H2O là 27 gam.
→nC : nH = 1 : 3
⇒ 2n + 3 = 3n ⇒ n = 3
Vậy công thức của amin là C3H9N.
Lời giải
Gọi CTTQ của A là CnH2n+2
Ta có:
Vậy CTPT của A là C5H12
Vì khi clo hóa A theo tỉ lệ 1 : 1 chỉ thu được 1 môn duy nhất , do đó :
CTCT của X là
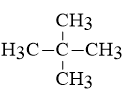
Câu 25: Đốt cháy hoàn toàn một hidrocacbon X thu được 8,96 lít khí CO2 (đktc) và 9 gam nước. Xác định CTPT của X.
A. C4H10;
B. C5H12;
C. C4H8;
D. C5H10.
Lời giải
Đáp án đúng là: A
→ C : H = 0,4 : 1 = 4 : 10
→ X là C4H10.
Câu 26: Để trung hòa 100ml dung dịch H2SO4 1M cần V ml NaOH 1M. Giá trị của V là
A. 200;
B. 150;
C. 50;
D.100.
Lời giải
Đáp án đúng là: A
Lời giải:
Ta có:
mFe = 1.84% = 0,84 tấn
Vì hiệu suất là 86%
(tấn)
→ mquặng = (tấn).
Lời giải:
Ta có mdd sau phản ứng = m1 + m2
Ta có
Lời giải:
Ta có:
Gọi a là số mol của Cu và b là số mol của Al.
Theo đề bài ta có hệ phương trình:
%mAl = 100% - 78,05% = 21,95%.
Câu 30: Điều chế: SO2, CaO, H2SO4, NaOH, Al, Fe (gang-thép)
Lời giải:
* Điều chế SO2:
- Trong PTN:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
- Trong công nghiệp:
* Điều chế CaO trong công nghiệp:
* Điều chế H2SO4 trong công nghiệp:
(Hoặc )
SO3 + H2O → H2SO4
* Điều chế NaOH trong công nghiệp:
* Điều chế Al trong công nghiệp:
* Điều chế Fe trong công nghiệp:
Mg + FeSO4 → MgSO4 + Fe
* Điều chế gang-thép trong công nghiệp:
- Điều chế gang: Dùng CO khử oxit sắt trong lò cao, sắt nóng chảy kết hợp với cacbon và một số phi kim tạo thành gang.
- Điều chế thép: Oxi hoá bớt một số nguyên tố trong gang như C,Mn,Si,...
Câu 31: Điều chế O2 trong phòng thí nghiệm bằng cách:
A. Nhiệt phân KClO3 có MnO2 xúc tác;
B. Điện phân nước;
C. Điện phân dung dịch NaOH;
D. Chưng cất phân đoạn không khí lỏng.
Lời giải:
Đáp án đúng là: A
Nguyên tắc điều chế O2 trong phòng thí nghiệm: Nhiệt phân các hợp chất giàu oxi và kém bền với nhiệt. Vậy để điều chế O2 trong phòng thí nghiệm người ta nhiệt phân KClO3 có MnO2 xúc tác.
Phương trình hóa học xảy ra: 2KClO3 2KCl + 3O2
Lời giải
Axit sunfuric để lâu ngoài không khí sẽ hút ẩm từ không khí, do đó khối lượng tăng lên.
A. 1,2 g.
B. 4,25 g.
C. 1,88 g.
D. 2,52 g.
Lời giải
Đáp án đúng là: A
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo phản ứng (1), số mol Cu:
→ mCu = 0,45.64 = 28,8 (g)
→ mCuO = 30 – 28,8 = 1,2 (g).
Câu 34: Cách để xác định được điều kiện bền của nguyên tử là gì?
Lời giải
Các hạt nguyên tử bền luôn có số proton, nơtron thoả mãn hệ thức p ≤ n ≤ 1,5p
Trong trường hợp không thoả mãn, nguyên tử đó thuộc về đồng vị phóng xạ của nguyên tố, không bền và dễ bị phân rã thành các hạt nhân khác nhỏ hơn.
Câu 35: Giải thích các hiện tượng ăn mòn kim loại như:
1. Đinh sắt trong không khí khô không bị ăn mòn.
2. Đinh sắt trong nước có hòa tan khí oxi ăn mòn chậm.
3. Đinh sắt trong dung dịch muối ăn NaCl bị ăn mòn nhanh.
4. Đinh sắt trong nước cất không bị ăn mòn.
Lời giải:
- Ăn mòn kim loại là sự phá hủy kim loại, hợp kim trong môi trường tự nhiên.
- Nguyên nhân: do kim loại tác dụng với những chất mà nó tiếp xúc trong môi trường (nước, không khí, đất)
Ví dụ:
Fe + 3Cl2 2FeCl3
3Fe + 4H2O Fe3O4 + 4H2
3Fe + 2O2 Fe3O4
- Sự ăn mòn kim loại không xảy ra hoặc xảy ra nhanh hay chậm phụ thuộc vào các chất có trong môi trường.
Ví dụ:
+ Đinh sắt trong không khí khô không bị ăn mòn
+ Đinh sắt trong nước có hòa tan oxi bị ăn mòn chậm
+ Đinh sắt trong dung dịch muối ăn bị hòa tan nhanh
+ Đinh sắt trong nước cất không bị ăn mòn
- Ở nhiệt độ cao sẽ làm cho sự ăn mòn xảy ra nhanh hơn
Câu 36: Công thức hóa học điphotpho pentaoxit là:
A. P2O5;
B. P2O3;
C. PO
D. P5O2.
Lời giải:
Tiền tố: đi = 2, penta = 5
Nên công thức hóa học điphotpho pentaoxit là P2O5.
Lời giải:
Ở 85oC, ,tức là:
87,7 gam CuSO4 tan tối đa trong 100 gam nước tạo thành 187,7 gam dung dịch bão hòa
Vậy x gam CuSO4 tan tối đa trong y gam nước tạo thành 1877 gam dung dịch bão hòa
⇒ y = 1877 – x = 1877 – 877 = 1000 (gam)
Gọi
Sau khi tách tinh thể :
Suy ra : Ở 12oC
⇒a = 4,0765
Câu 38: Độ tan của NaCl trong nước ở 20oC là 36 gam. Khi hòa tan 14 gam NaCl vào 40 gam nước thì phải hòa tan thêm bao nhiêu gam NaCl nữa để dung dịch bão hòa?
Lời giải:
Nồng độ khi dung dịch bão hoà:
Đặt mNaCl thêm = x (g)
Ta có:
Vậy cần thêm 0,42 gam NaCl.
Câu 39: Độ dinh dưỡng của phân lân là:
A. % Ca(H2PO4)2.
B. % P2O5.
C. % P.
D. %
Lời giải:
Đáp án đúng là: B
Độ dinh dưỡng của phân lân được đánh giá theo tỉ lệ phần trăm khối lượng P2O5 tương ứng với lượng P có trong thành phần của nó.
Lời giải:
nFe = 0,2 (mol); nHCl = 0,44 (mol); = 0,02 (mol)
Bảo toàn H:
m1 = mFe + mO = 14,4 gam
nAgCl = nHCl = 0,44 (mol)
Bảo toàn electron: 3nFe = 2nO + 2 + nAg → nAg = 0,16 (mol)
→ m2 = mAgCl + mAg = 80,42 gam.
A. CH2O2.
B. CH2O.
C. C2H5O.
D. C2H4O.
Lời giải:
Đáp án đúng là: D
= 0,2 (mol) ⇒ nC = 0,2 (mol) ⇒ mC = 2,4 (g)
= 0,2 (mol) ⇒ nH = 0,4(mol) ⇒ mH = 0,4 (g)
Ta có: mC + mH = 2,8 < 4,4
=> Trong phân tử X có chứa O
CTDC: CxHyOz
mO = 4,4 − 2,8 = 1,6 (g) ⇒ nO = 0,1 (mol)
x : y : z = 0,2 : 0,4 : 0,1 = 2 : 4 : 1
Công thức đơn giản nhất của hợp chất hữu cơ X là C2H4O.
Câu 42: Đốt cháy hoàn toàn 50,4 gam sắt trong bình chứa khí oxi thu được oxit sắt từ (Fe3O4).
a. Hãy viết phương trình phản ứng xảy ra
b. Tính thể tích khí O2 (ở đktc) đã tham gia phản ứng
c. Tính khối lượng sản phẩm thu được
d. Tính khối lượng KClO3 cần dùng để phân huỷ thì thu được 1 thể tích khí O2 (ở đktc) bằng thể tích khí O2 đã sử dụng ở phản ứng trên.
Lời giải:
b. Ta có:
Theo phương trình
c. Theo phương trình:
A. 50% C2H4 và 50% C3H6;
B. 60% C2H4 và 40% C3H6;
C. 50% C3H6 và 50% C4H8;
D. 60% C4H8 và 40% C5H10.
Lời giải:
Đáp án đúng là: B
→ 2 anken là C2H4 (x mol) và C3H6 ( y mol)
Ta có: x + y = 0,25 và 2x + 3y = 2,4.0,25
→ x = 0,15
Lời giải:
m1tăng =
Dư Ca(OH)2 nên ta có:
Số
Số
Số
Vậy CTPT của X là C3H6O2.
Câu 45: Đốt cháy 2,8 lít khí hiđro trong không khí.
a) Viết PTHH?
b) Tính thể tích và khối lượng của khí oxi cần dùng
c) Tính khối lượng nước thu được (Thể tích thu được ở đktc).
Lời giải:
a) PTHH:
b)
Theo PTHH:
c) Theo PTHH:
Lời giải:
;
PTHH:
Lập tỉ lệ: → O2 dư, S hết
Theo PTHH:
Lời giải:
Nhận thấy: Khối lượng chất rắn trong bình tăng bằng chính khối lượng của Cl2 phản ứng.
PTHH: 2Al + 3Cl2 → 2AlCl3
Theo PTHH:
→ mAl = 0,04.27 = 1,08 (g).
A. C2H5ON hoặc C2H7O2N;
B. C2H5O2N;
C. C2H7O2N;
D. C2H5ON.
Lời giải
Gọi lần lượt là: x, y (mol)
→ x + y = 0,025 (1)
Mà MZ = 20,4.2 = 40,8 → mZ = 40,8.0,025 = 1,02 (g)
→ 44x + 28y = 1,02 (2)
Từ (1), (2) ta có hệ phương trình:
Gọi công thức của X là CxHaObNy
→ Công thức của X là C2HaObN (Với a,b Z; )
Khi đó:
Kết hợp với điều kiện trên ta chỉ có cặp nghiệm duy nhất thỏa mãn là: a = 7; b = 2.
Vậy CTPT của X: C2H7O2N.
a) Tìm phân tử khối của D
b) Xác định công thức phân tử của D
Lời giải
Đốt cháy hoàn toàn D thu được CO2; H2O nên D chứa C, H và có thể chứa O.
D có dạng CxHyOz
Bảo toàn nguyên tố O:
Vậy D là C3H8O → MD = 12.3 + 8 + 16 = 60 (g/mol).
Lời giải
Số
Số
→ D là C2H6, C2H6O, C2H6O2.
Công thức cấu tạo:
CH3 – CH3
CH3 – CH2 – OH; CH3 – O – CH3
CH2OH – CH2OH.