Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (Phần 19)
Câu 1:Khi cho NH3 dư tác dụng với Cl2 thu được?
Lời giải:
Đầu tiên xảy ra phản ứng:
2NH3 + 3Cl2 → N2 + 6HCl
Sau đó, vì dư amoniac nên:
NH3 + HCl → NH4Cl
Vậy các chất thu được là NH4Cl, N2 và NH3 dư nếu có.
Câu 2: Khi cho thanh Fe (dư) vào 200 ml dung dịch CuSO4 nồng độ x (M). Sau khi phản ứng xảy ra hoàn toàn, thấy khối lượng chất rắn tăng 0,8 gam so với ban đầu. Giá trị của x là:
A: 2;
B: 1;
C: 1,5;
D: 0,5.
Lời giải:
Đáp án đúng là: D
Fe + CuSO4 → FeSO4 + Cu
a…………………………a (mol)
mchất rắn tăng = mCu – mFe = 64a – 56a = 0,8 → a = 0,1
Câu 3: Khi đốt dây sắt, sắt phản ứng cháy với oxi theo phương trình:
.Tính thể tích O2 (đktc) cần dùng để phản ứng hoàn toàn với 16,8 gam Fe?
Lời giải:
PTHH:
Ta có:
Theo PTHH:
Vậy thể tích khí oxi ở đktc cần dùng là 4,48 (l).
Câu 4: Khi để lâu trong không khí thì trên bề mặt dung dịch nước vôi trong sẽ có một lớp váng màu trắng . Hãy giải thích tại sao và viết PTHH xảy ra.
Lời giải:
Nước vôi trong tác dụng với khí cacbonic có trong không khí tạo thành canxi cacbonat không tan trong nước, do đó khi để lâu trong không khí thì bề mặt dung dịch nước vôi trong sẽ có một lớp váng màu trắng.
PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O
Lời giải:
Gọi CTTQ của A là CxHyOzNt
có:
Ta có :
Vậy CT của A là C2H5OzN
mà MA = 12.2 + 5 + 16z + 14 = 59
⇒z = 1
Vật CTPT của A là C2H5ON.
a. Tìm CTPT của ankan đó.
b. Viết CTCT có thể có và đọc tên theo IUPAC
Lời giải:
Gọi số mol của CO2 và H2O lần lượt là x và y mol.
Ta có: gam → 44x − 18y = 3,36 (1)
Bảo toàn nguyên tố C, H:
Từ (1) và (2) suy ra: x = 0,15; y = 0,18
Số C
Số H
CTPT: C5H12
b. CTCT:
CH3 − CH2 − CH2 − CH2 − CH3: n−pentan
CH3 − CH(CH3) – CH2 – CH3: 2−metylbutan
CH3 − C(CH3)2 − CH3: 2,2− đimetylpropan
A. 1,2 g.
B. 4,25 g.
C. 1,88 g .
D. 2,52 g.
Lời giải:
Đáp án đúng là: A
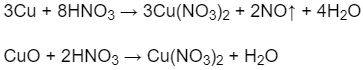
Số mol khí NO:
![]()
Theo phản ứng (1) số mol Cu:
![]()
Khối lượng Cu trong hỗn hợp ban đầu: mCu = 0,45.64 = 28,8 (g).
Khối lượng CuO trong hỗn hợp ban đầu: mCuO = 30 - 28,8 = 1,2 (g).
Câu 8: Khi nào phản ứng hoá học cần có nhiệt độ?
Lời giải:
Các phản ứng thu nhiệt là các phản ứng cần thêm nhiệt độ t0.
Ngoài ra nhiệt độ là một động lực thúc đẩy tốc độ phản ứng diễn ra nhanh hơn.
Các phản ứng giữa kim loại với phi kim, phi kim với phi kim và phản ứng phân hủy thường cần thêm nhiệt độ vào phản ứng. (ngoài ra còn một số phản ứng tổng hợp hữu cơ)
VD:
Kim loại với phi kim:
Phi kim với phi kim:
Phân hủy:
Phản ứng hữu cơ:
Câu 9: Nhiệt phân Cu(NO3)2. Phần trăm thể tích NO2 trong hỗn hợp khí thu được là?
Lời giải:
Gọi
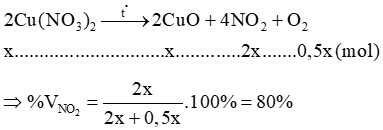
Câu 10: Nung nóng 11,28 gam Cu(NO3)2 một thời gian thu được 6,96 gam chất rắn
a) Tính hiệu suất phản ứng?
b) Hấp thụ toàn bộ lượng khí vào 120 gam H2O được dung dịch X. Tính C% của dd X?
Lời giải:
Gọi x là số mol Cu(NO3)2 phản ứng
⇒mrắn = 11,28 − 188x + 80x = 6,96
⇒x = 0,04 (mol)
b,
Theo PTHH:
mdd = 120 + 3,68 = 123,68 (g)
a) Tính khối lượng của khí cacbonic sinh ra nếu khối lượng malachite mang nung là 2,22 gam, thu được 1,60 gam đồng (II) oxit và 0,18 gam nước.
b) Nếu thu được 6 gam đồng (II) oxit; 0,9 gam nước và 2,2 gam khí cacbonic thì khối lượng quặng đem đi nung là bao nhiêu?
Lời giải:
Quặng: Cu(OH)2.CuCO3
Áp dụng định luật bảo toàn khối lượng:
b) mquặng = = 6 + 0,9 + 2,2 = 9,1 (g)
Câu 12: Khi thủy phân este HCOOCH2CH=CH2 bằng kiềm ta được:
A. 2 muối và nước;
B. 1 muối và 1 andehit;
C. 1 muối và 1 xeton;
D. 1 muối và 1 ancol.
Lời giải:
Đáp án đúng là: D
Sản phẩm thuỷ phân bằng NaOH: HCOONa (muối), CH2=CHCH2OH (ancol)
OH không gắn vào cacbon không no nên sản phẩm là ancol, không chuyển thành anđehit, xeton.
A. 13;
B. 9;
C. 12;
D. 12,3.
Lời giải:
Đáp án đúng là: C
Gọi V1 = V2 = 1 thì sau khi trộn: n(HNO3) = 0,01 và n(NaOH) =0,03
Axit + Bazo theo tỉ lệ 1:1 nên NaOH dư = 0,02 mol
Vậy [OH- ] dư =0,02 : 2 =0,01 suy ra p[OH] = - log(0,01) = 2
Như vậy pH = 14 - 2 = 12.
Lời giải:
Ta có:
Gọi a là số mol của Cu và b là số mol của Al.
Ta có các quá trình:
Theo đề bài ta có hệ phương trình:
%mAl = 100% - 78,05% = 21,95%.