Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (Phần 13)
Câu 1: Cho sơ đồ phản ứng sau: Fe2O3 + CO Fe + CO2
a) Lập phương trình hóa học
b) Hãy cho biết tỉ lệ số nguyên tử, phân tử của các chất trong phản ứng trên.
c) Cho 16,8 kg CO tác dụng với 32 kg Fe2O3 tạo ra 26,4 kg CO2, tính khối lượng sắt thu được?
Lời giải:
a) Fe2O3 + 3CO 2Fe + 3CO2
b) Tỉ lệ: 1 : 3 : 2 : 3
c) Bảo toàn khối lượng: = 32 + 16,8 – 26,4 = 22,4(kg).
Lời giải:
Đáp án đúng là: D
Để hạn chế ảnh hưởng của khí nâu đỏ đó thoát ra gây ô nhiệm môi trường, bạn An đã nút ống nghiệm bằng bông tẩm dung dịch NaOH vì:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
Lời giải:
Đáp án đúng là: D
Ta có:
→ Tạo 2 muối
Ca(OH)2 + CO2 → CaCO3 + H2O
x……………x………x (mol)
Ca(OH)2 + 2CO2 → Ca(HCO3)2
y……………2y………y (mol)
mmuối = 0,1.100 + 0,05.162 = 18,1 (g).
A. Liên kết của X với Y là liên kết cộng hoá trị;
B. Nguyên tố X thuộc chu kì 2, nhóm VIA;
C. Hợp chất khí của Y với hiđro chứa 5,88% khối lượng hiđro;
D. Oxit cao nhất của Y chứa 40% khối lượng oxi.
Lời giải:
Đáp án đúng là: D
Giả sử trong nguyên tử X: số p = số e = Z và số n = N
X + 2e → X2-
→ Số hạt trong ion X2- là: Số p = Z; Số e = Z + 2; Số n = N
Theo đề bài:
+ Ion X2- có tổng số hạt p, n, e là 26 → Z + Z + 2 + N = 26
+ Số hạt mang điện nhiều hơn số hạt không mang điện là 10
→ Z + Z + 2 - N = 10
Giải hệ trên ta được Z = 8 và N = 8 → X là oxi.
Nguyên tử X có số hạt mang điện là 2Z = 16.
Nguyên tử Y có số hạt mang điện nhiều hơn số hạt mang điện của nguyên tử X là 16 nên số hạt mang điện của nguyên tử Y là 16 + 16 = 32
Suy ra số hạt proton = số hạt electron của nguyên tử Y bằng 32 : 2 = 16.
Vậy nguyên tố Y là nguyên tố lưu huỳnh.
Phát biểu A. Liên kết của X với Y là liên kết cộng hóa trị là phát biểu đúng.
Phát biểu B. Nguyên tố X thuộc chu kì 2, nhóm VIA đúng vì X có cấu hình electron nguyên tử là 1s22s22p4. X thuộc chu kì 2 vì có 2 lớp electron, nhóm VIA vì có 6 e ở lớp ngoài cùng.
Phát biểu C. Hợp chất khí của Y với hiđro chứa 5,88% khối lượng hiđro đúng vì công thức hợp chất khí với H của S là H2S.
Ta có %mH = 2.100%/34 = 5,88%
Phát biểu D. Oxit cao nhất của Y chứa 40% khối lượng oxi là phát biểu sai vì công thức oxit cao nhất của Y là SO3 có %mO = 60%.
Lời giải:
Gọi x (mol) là số mol của CO2
⇒ = M.n = 44x gam
CO2 + Ca(OH)2 → CaCO3 + H2O
⇒ = x mol ⇒ = M.n =100x (g)
Ta có: mkết tủa - = mdd giảm
⇔ 100x - 44x = 5,6 ⇔ x = 0.1
⇒ V = = 0.1.22.4 = 2.24 lít
⇒ a = = 100.0.1 = 10 g
Lời giải:
Đun kĩ dung dịch X thu thêm 50 gam kết tủa
→ Phản ứng sinh ra hai muối CaCO3 và Ca(HCO3)2
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3 + H2O
1,5 ←1,5 (mol)
2CO2 + Ca(OH)2 → Ca(HCO3)2
1 ← 0,5 (mol)
Ca(HCO3)2 CaCO3 + CO2 + H2O
0,5 ←0,5 (mol)
= 1,5 + 1 = 2,5 (mol)
= 2,5.22,4 = 56 lít.
Lời giải:
Vì : Dung dịch + NaOH → Kết tủa
→ Dung dịch có chứa: Ba(HCO3)2
Bảo toàn nguyên tố C:
Lời giải:
Gọi kim loại là M suy ra oxit là MO
Giả sử có 1 mol MO.
Phản ứng xảy ra:
MO + 2HCl → MCl2 + H2O
nHCl = 2nMO = 2 mol→ mHCl = 2.36,5 = 73 gam
→
BTKL: mdd sau phản ứng = mMO + mdd HCl = 1.(MM + 16) + 730 = MM + 746 (g)
Vậy M là Mg, suy ra oxit là MgO.
Gọi hóa trị của R là n
PTHH : 2R + nH2SO4 → R2(SO4)n + nH2
Theo PTHH:
⇒ MR = 9n
Ta có bảng sau :
|
n |
I |
II |
III |
|
MR |
9 |
18 |
27 |
|
KL |
Loại |
Loại |
Al |
Vậy R là kim loại Al.
Lời giải:
PTHH: Mg + 2HCl → MgCl2 + H2
x……2x……...x……….x (mol)
Zn + 2HCl → ZnCl2 + H2
y……2y……...y………y (mol)
Ta có hệ phương trình:
mmuối =
a) Tính % về khối lượng của từng kim loại có trong hỗn hợp
b) Dẫn toàn bộ lượng khí trên qua 16 gam bột CuO đun nóng đến pư kết thúc. Tính m Cu thu được?
Lời giải:
PTHH:
2Al + 6HCl → 2AlCl3 + 3H2
a…….3a………………..3/2a (mol)
Fe + 2HCl → FeCl2 + H2
b……2b………………b (mol)
Theo đề bài ra, ta có hệ:
a) mAl = 27.0,2 = 5,4 (g)
mFe = 11 – 5,4 = 5,6 (g)
b) Ta có số mol HCl là:
nHCl = 3.0,2 + 2.0,1 = 0,8 (mol)
Lời giải:
Đáp án đúng là: B
Ta có H = 30%
Lời giải:
PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 (1)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (2)
Theo PTHH (1):
→ mAl = 0,2.27 = 5,4 (g)
→
Lời giải:
Đáp án đúng là: B
PTHH:
Fe + 2HCl → FeCl2 + H2
0,1……………………0,1 (mol)
Câu 15: Cho 200 gam dung dịch BaCl2 10,4% tác dụng vừa đủ với 400 gam dung dịch Na2SO4
a) Viết PTHH xảy ra?
b) Tính khối lượng kết tủa tạo thành?
c) Tính nồng độ phần trăm của các chất còn lại trong dung dịch thu được sau khi đã lọc bỏ kết tủa?
Lời giải:
a) BaCl2 + H2SO4 → BaSO4↓ + 2HCl
b)
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
0,1………………..0,1 (mol)
c) Dung dịch còn lại là NaCl
Áp dụng định luật bảo toàn khối lượng:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
0,1…………………………….0,2 (mol)
mNaCl = 0,2.58,5 = 11,7 (g)
Lời giải:
Tỉ lệ về thể tích bằng tỉ lệ về số mol
Coi số mol mỗi khí ban đầu là 1
Ban đầu: 1 1
Phản ứng: 0,6 → 0,2 → 0,4
Cân bằng: 0,4 0,8 0,4
Số mol hỗn hợp sau phản ứng: 0,4 + 0,8 + 0,4 = 1,6 (mol
Lời giải:
Ta có nkhí = 0,14 mol
→ nN (trong khí) = nkhí = 0,14 mol
Bảo toàn N → trong muối = 0,44 - 0,14 = 0,3 mol
Ta có mCu = 0,7m mà khối lượng rắn = 0,75m
→ Fe phản ứng chưa hết → muối tạo thành là Fe(NO3)2
BTKL → m - 0,75m = 0,25m = 0,15.56
→ m = 33,6 gam.
Lời giải:
PTHH: CuO + H2SO4 → CuSO4 + H2O
0,2…..0,2……….0,2 (mol)
CM của dung dịch muối là:
mdd = 196 + 16 = 212 (g)
Câu 19: Phát biểu nào sau đây sai?
A. Bản chất của sự điện phân là phản ứng oxi hoá – khử xảy ra trên bề mặt điện cực dưới tác dụng của dòng điện;
B. Để bảo vệ tàu biển làm bằng thép người ta gắn tấm Zn vào vỏ tàu ở phần chìm trong nước biển. Bản chất của việc làm này là sử dụng biện pháp ăn mòn điện hoá để chống ăn mòn kim loại.
C. Bản chất của sự ăn mòn hoá học là phản ứng oxi hoá – khử xảy ra trong đó kim loại bị oxi hoá có phát sinh ra dòng điện.
D. Dung dịch đất trồng trọt chua có màu vàng là do các hợp chất Fe (III) gây nên.
Lời giải:
Đáp án đúng là: C
Trong quá trình ăn mòn hoá học thì kim loại chuyển electron trực tiếp vào các chất trong môi trường và không phát sinh dòng điện → C sai
Trong quá trình điện phân thì dưới tác dụng của dòng điện bên anot xảy ra quá trình nhường electron, bên catot xảy ra quá trình nhận electron → xảy ra phản ứng oxi hoá khử trên bề mặt điện cực → A đúng
Để bảo vệ tàu biển làm bằng thép người ta gắn tấm Zn vào vỏ tàu ở phần chìm trong nước biển. Zn có tính khử mạnh hơn Fe và tốc độ ăn mòn chậm hơn → được dùng làm kim loại hi sinh để bảo vệ sắt (bảo vệ điện hoá) → B đúng
Các hợp chất Fe (III) thường có màu vàng → D đúng.
A. O2;
B. CO2;
C. H2;
D. N2.
Lời giải:
Đáp án đúng là: A
Trong công nghiệp, nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng. Sau khi đã loại bỏ CO2 và hơi nước, không khí được hoá lỏng dưới áp suất cao và nhiệt độ thấp. Nâng dần nhiệt độ không khí lỏng đến – 1960C thì nitơ sối và được tách khỏi oxi lỏng vì oxi có nhiệt độ sôi sao hơn (- 1830C). Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150 atm.
Câu 21: Viết phương trình chứng minh CO2 có tính oxi hoá?
Lời giải:
CO2 có phản ứng oxi hóa với một số chất có tính khử mạnh như C; Mg...
Câu 22: Trong các phát biểu sau, phát biểu đúng là:
A. Điện tích của electron bằng điện tích của nơtron;
B. Khối lượng của proton bằng điện tích của nơtron;
C. Điện tích của proton bằng điện tích của nơtron;
D. Có thể chứng minh sự tồn tại của electron bằng thực nghiệm.
Lời giải:
Đáp án đúng là: D
A. 4;
B. 5;
C. 6;
D. 3.
Lời giải:
Đáp án đúng là: D
Các thí nghiệm làm thay đổi số oxi hoá của kim loại là:
3Cl2 + 2NaCrO2 + 8NaOH → 2Na2CrO4 + 6NaCl + 4H2O ()
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3 ()
2CrCl2 + Cl2 → 2CrCl3 ()
Câu 24: Cân bằng phương trình:
CnH2n+1OH + O2 → CO2 + H2O
Lời gải:
Câu 25: Hoàn thành phương trình:
CO + 2Fe →……
Lời gải:
Phản ứng không xảy ra nên không có phương trình trên.
Lời giải:
Đánh số thứ tự và trích mẫu thử các dung dịch:
Cho dung dịch NaOH vào mẫu thử, đun nhẹ:
- Nhận ra MgCl2 tạo kết tủa trắng
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
- Nhận ra NaNO3 do không có hiện tượng gì
- NH4Cl và NH4NO3 tạo khí mùi khai thoát ra:
NH4Cl + NaOH → NH3↑ + H2O + NaCl
NH4NO3 + NaOH → NH3↑ + H2O + NaNO3
Cho dung dịch AgNO3 vào mỗi mẫu thử:
- Nhận ra NH4Cl tạo kết tủa trắng:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- Nhận ra NH4NO3.
Câu 27: Có 7 lọ đựng 7 dung dịch mất nhãn được đánh số từ (1) đến (7) gồm: (NH4)2CO3, BaCl2, MgCl2, H2SO4, Ba(OH)2, NaOH, Na2CO3. Thực hiện các thí nghiệm được kết quả như sau:
- Chất (1) tác dụng với chất (4) hoặc (5) đều tạo ra kết tủa; tác dụng với chất (2) hoặc (7) đều tạo ra khí.
- Chất (2) tác dụng với chất (4) hoặc (5) đều tạo ra kết tủa, tác dụng với chất (3) tạo ra khí; tác dụng với chất 6 thì tạo ra cả kết tủa lẫn khí.
- Chất (5) tác dụng với chất (3), (6) hoặc (7) đều tạo ra kết tủa.
- Chất (7) tác dụng với chất (4) hoặc (6) đều tạo ra kết tủa. Hãy biện luận để xác định các chất từ (1) đến (7).
Lời giải:
Lập bảng:
|
(NH4)2CO3 |
BaCl2 |
MgCl2 |
H2SO4 |
Ba(OH)2 |
NaOH |
Na2CO3 |
|
|
(NH4)2CO3 |
↓ |
↓ |
↑ |
↓; ↑ |
↑ |
||
|
BaCl2 |
↓ |
↓ |
↓ |
||||
|
MgCl2 |
↓ |
↓ |
↓ |
↓ |
|||
|
H2SO4 |
↑ |
↓ |
↓ |
↑ |
|||
|
Ba(OH)2 |
↓; ↑ |
↓ |
↓ |
↓ |
|||
|
NaOH |
↑ |
↓ |
Không hiện tượng |
||||
|
Na2CO3 |
↓ |
↓ |
↑ |
↓ |
Theo đề bài:
1: H2SO4
2: (NH4)2CO3
3: NaOH
4: BaCl2
7: Na2CO3
5: MgCl2
6: Ba(OH)2
Lời giải:
CTHH đúng là: MgO, Na2O, Cu(OH)2, K2CO3, H2SO4
CTHH sai là: CaCl, Fe3O2 NaHPO4, Al3(SO4)2.
Sửa CTHH sai: CaCl2, Fe2O3, Na2HPO4, Al2(SO4)3.
A. 4;
B. 3;
C. 2;
D. 1.
Lời giải:
Đáp án đúng là: C
(a) sai vì điện tích của hạt proton là luôn dương(+), còn electron thì lại là (-). nói chúng bằng nhau là sai, nếu muốn nói đúng thì phải là "số điện tích hạt proton bằng số điện tích hạt electron"
(b) sai vì khối lương của proton nặng hơn nhiều khối lượng của electron (mproton ≈ 1,67.10-24 (g); melectron ≈ 9,11.10-27 (g)).
Trích dẫn mẫu thử:
− Đổ từ từ đến dư mẫu thử này vào mẫu thử còn lại.
Nếu ban đầu không có hiện tượng gì 1 thời gian sau xuất hiện kết tủa tăng dần tới lớn nhất sau đó bị hòa tan thì ban đầu là B, chất đổ vào là A.
KOH + HCl → KCl + H2O
3KOH + AlCl3 → 3KCl + Al(OH)3↓
KOH + Al(OH)3 → KAlO2 + 2H2O
⇒ Dán nhãn vào các chất vừa nhận biết.
Câu 31: Có một oxit sắt chưa rõ công thức, chia oxit thành hai phần bằng nhau:
a) Để hòa tan hết phần 1 cần dùng 150 ml dung dịch HCl 1,5M
b) Cho luồng khí H2 dư vào phần 2 nung nóng, phản ứng xong thu được 4,2 gam Fe.
Tìm công thức oxit sắt.
Lời giải
Gọi CTHH của oxit sắt là FexOy
Ta có: x : y = 0,075 : 0,1125 = 2 : 3
Vậy oxit sắt cần tìm là Fe2O3.
Lời giải
Không phải mọi sự biến đổi các chất đều thuộc lĩnh vực hóa học
Ví dụ:
- Biển đổi thuỷ năng thành điện năng là biển đổi vật lí.
- Nghiền nhỏ đá vôi thành vôi bột là biến đổi vật lí.
Câu 33: Thực hiện chuỗi phản ứng:
![]()
C → CO2 → Ca(HCO3)2 → CaCO3 → CO2
CO → CO2 → Na2CO3
Lời giải:
CO2 + Ca(OH)2 → Ca(HCO3)2
CO2 + 2NaOH → Na2CO3 + H2O
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl
A. C2H4 và C4H8;
B. CH4 và C2H6;
C. C3H4 và C5H8;
D. CH4 và C3H8.
Lời giải:
Đáp án đúng là: D
→ → 2 hiđrocacbon là ankan
→
→ Có 1 ankan có số C < 2 và 1 ankan có số C > 2
→ 2 ankan thoả mãn là CH4 và C3H8.
Lời giải:
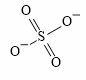
Lời giải:
Ta có:
x là hóa trị của (SO4) vậy x = 2
y là hóa trị của Fe vậy y = 3 hoặc y = 2
Do x, y khác nhau suy ra y = 3.
Vậy ta có phương trình phản ứng
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Câu 37: Viết công thức electron và công thức cấu tạo của H2CO3?
|
Chất |
Công thức electron |
Công thức cấu tạo |
|
H2CO3 |
|
|
a. Viết công thức electron, công thức cấu tạo của CO2.
b. Giải thích sự hình thành liên kết trong phân tử KCl. Viết phương trình phản ứng biểu diễn sự di chuyển electron.
Lời giải:
a. Công thức electron là O :: C :: O
Công thức cấu tạo của là O = C = O
b. Giải thích sự hình thành liên kết trong phân tử KCl, viết phương trình phản ứng biểu diễn sự di chuyển electron.
K → K+ + 1e
Cl + 1e → Cl-
K+ + Cl- → KCl
2K + Cl2 → 2KCl
Câu 39: Viết công thức electron và công thức cấu tạo của: Na2SO4, KNO3?
Lời giải:
|
Chất |
Công thức electron |
Công thức cấu tạo |
|
Na2SO4 |
2Na+ + |
2Na+ + |
|
KNO3 |
K+ + |
K+ + |
Lời giải:
|
Chất |
Công thức electron |
Công thức cấu tạo |
|
I2 |
|
I − I |
|
Br2 |
|
Br – Br |
|
HBr |
|
H – Br |
|
HI |
|
H – I |
|
H2O |
|
H – O – H |
|
HF |
|
H – F |
|
NH3 |
|
|
|
PH3 |
|
|
|
CH4 |
|
|
|
C2H4 |
|
|
|
C2H2 |
|
|
Câu 41: Lập công thức hoá học tạo bởi Ca và
Lời giải:
CTHH dạng chung: Cax(CO3)y
Theo quy tắc hóa trị: x × II = II × y
Chuyển thành tỉ lệ:
⇒ x=1; y=1
Vậy CTHH là CaCO3.
(1) 2Cu + O2 2CuO
(2) CuO + H2SO4 → CuSO4 + H2O
(3) CuSO4 + BaCl2 → BaSO4↓ + CuCl2
(4) CuCl2 + 2AgNO3 → 2AgCl↓ + Cu(NO3)2
(5) Cu(NO3)2 + 2NaOH → Cu(OH)2↓+ 2NaNO3
(6) Cu(OH)2 CuO + H2O
(7) CuO + H2 Cu + H2O.
Câu 43: CuCl2 rắn tác dụng với H2SO4 đặc được không?
Lời giải:
CuCl2 rắn không tác dụng với H2SO4 đặc vì không thoả mãn điều kiện của phản ứng trao đổi. (Phản ứng trao đổi chỉ xảy ra khi có 1 chất kết tủa hoặc 1 chất bay hơi).
Câu 44: CuCl2 có tác dụng với Na2SO4 được không?
Lời giải:
Phản ứng giữa 2 muối là phản ứng trao đổi, mà phản ứng trao đổi chỉ xảy ra khi có 1 chất kết tủa hoặc 1 chất bay hơi
Ở đây nếu trao đổi với nhau thì tạo thành CuSO4 và NaCl, mà 2 chất này không phải là chất rắn (không kết tủa)
⇒ Vậy nên CuCl2 không tác dụng được với Na2SO4.
Câu 45: Cân bằng thăng bằng electron phản ứng sau:
CuFeSx + O2 Cu2O + Fe3O4 + SO2
Lời giải:
12CuFeSx + (11+12x)O2 6Cu2O + 4Fe3O4 + 12xSO2
Lời giải:
Vì SO2 là oxit axit. Oxit axit chỉ tác dụng với oxit của bazo tan mà CuO là oxit của bazo không tan nên SO2 không tác dụng với CuO.
Câu 47: Cho CuO tác dụng với axit HCl sẽ có hiện tượng
A. Không có hiện tượng gì.
B. CuO tan tạo thành dung dịch có màu xanh lam;
C. Tạo chất khí làm đục nước vôi trong;
D. Tạo chất khí cháy được trong không khí.
Lời giải:
Đáp án đúng là: B
CuO + 2HCl → CuCl2 + H2O
→ CuO tan, tạo thành dung dịch có màu xanh lam.
Câu 48: Phản ứng Cu với dung dịch HNO3 đặc, nóng xảy ra như sau:
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Sau khi cân bằng, nếu hệ số của Cu là 3 thì hệ số của HNO3 tương ứng là:
A. 8;
B. 9;
C. 12;
D. 15.
Lời giải:
Đáp án đúng là: C
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Sau khi cân bằng, nếu hệ số của Cu là 3 thì hệ số của HNO3 tương ứng là 12.
Câu 49: CuSO4 có tác dụng với NaCl được không?
Lời giải:
CuSO4 không tác dụng với NaCl.
Đây là phản ứng giữa hai muối nên cần phải bảo đảm điều kiện 2 muối tham gia phản ứng phải tan và sản phẩm muối sinh ra có ít nhất 1 muối không tan.
Mà hai chất ở trên khi tác dụng với nhau chỉ sinh ra muối tan.
→ Do đó, phản ứng ở trên chưa đảm bảo đủ điều kiện sản phẩm nên không xảy ra.
A. 12
B. 2,3
C. 2
D. 13
Lời giải
Đáp án đúng là: B
2NaCl + CuSO4 ![]() Cu + Cl2 + Na2SO4
Cu + Cl2 + Na2SO4
0,015 0,015
CuSO4 + H2O ![]() Cu + ½ O2 + H2SO4
Cu + ½ O2 + H2SO4
0,005 0,005 (mol)
→ pH = -lg[H+] = 2,3.