Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (Phần 18)
Lời giải:
Bảo toàn nguyên tố H:
Bảo toàn khối lượng
Đặt
m + 42,88 = 23.2x + 24y + 0,16.39 + 0,08.3.56 + 0,7.96 = 106x + 40y + 0,08.232 + 0,16.100 + 42,68 (2)
Từ (1), (2) ta có:
x = 0,11; y = 0,19
m = 106.0,11 + 0,19.40 + 0,08.232 + 0,16.100 = 53,82 (g).
a, So sánh hóa trị của M trong muối clorua và muối nitrat.
b, Hỏi M là kim loại nào ? Biết khối lượng muối nitrat tạo thành gấp 1,905 lần muối clorua.
Lời giải:
a, Coi V = 22,4 (lít)
Ta có:
Gọi n là hóa trị của kim loại M khi phản ứng với HCl
2M + 2nHCl → 2MCln + nH2
Theo PTHH :
Gọi m là hóa trị của kim loại M khi phản ứng với HCl
3M + 4mHNO3 → 3M(NO3)m + mNO + nH2
Theo PTHH :
Suy ra :
Vậy hóa trị của M trong muối clorua bé hơn muối nitrat.
b,
Vì
Theo PTHH :
mà
Vậy M là kim loại Fe.
a) Viết phương trình hóa học và tính m.
b) Tính nồng độ phần trăm của chất tan trong dung dịch X.
Lời giải:
a)
2Na + 2H2O → 2NaOH + H2↑
⇒m = 0,08.23 = 1,84 (g)
b)
mX = 1,84 + 100 − 0,04.2 = 101,76(g)
nNaOH = nNa = 0,08 (mol)
Lời giải:
PTHH: Ba + 2H2O → Ba(OH)2 + H2
a………………a………..a (mol)
2Na + 2H2O → 2NaOH + H2
a………………..a……….0,5a (mol)
→ a + 0,5a = 0,3 → a = 0,02 (mol)
PTHH: Ba(OH)2 + 2HCl → BaCl2 + 2H2O
0,02………0,04
NaOH + HCl → NaCl + H2O
0,02……0,02
→ nHCl = 0,04 + 0,02 = 0,06 (mol)
A. 8,32.
B. 4,16
C. 3,90
D. 6,40
Lời giải:
Đáp án đúng là: B
Ta có
Bảo toàn e:
Lời giải
Đặt số mol mỗi chất là a
Các phương trình hóa học xảy ra như sau:
K2O + H2O → 2KOH
a → 2a mol
KOH + KHCO3 → K2CO3 + H2O
a → a → a mol
NH4Cl + KOH → KCl + NH3 ↑+ H2O
a ← a → a mol
BaCl2 + K2CO3 → BaCO3 ↓ + 2KCl
a → a → a mol
Vậy Y là NH3; dung dịch Z là KCl; M là BaCO3.
Lời giải
ban đầu = 0,1.0,4 = 0,04 (mol)
→ Số mol axit H2SO4 phản ứng là 0,035 mol
dư = 0,04 – 0,035 = 0,005 (mol)
A. 17,71;
B. 16,10;
C. 32,20;
D. 24,15.
Lời giải:
Đáp án đúng là: B
Đặt 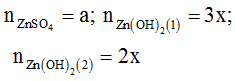
-Xét ở thí nghiệm 1
+ Nếu thì tạo thành kết tủa và kết tủa tan một phần
Và ở thí nghiệm 2 kết tủa cũng tan một phần
TN1: dung dịch sau phản ứng có ion:
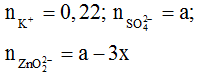
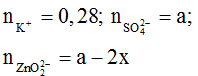
BTĐT:
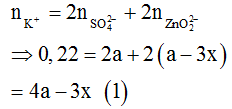
TN2: dung dịch sau phản ứng có ion:
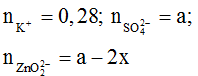
BTĐT:
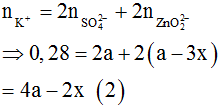
![]()
![]()
Với trường hợp thì không thỏa mãn
Câu 9: Hoà tan một lượng sắt vào 400 ml dung dịch HCl vừa đủ. Sau phản ứng thu được 3,7185 lít khí hiđro (đkc). Nồng độ M của dung dịch HCl là:
A. 0,25 M;
B. 0,5 M;
C. 0,75 M;
D. 1 M.
Lời giải:
Đáp án đúng là: C
Fe + 2HCl → FeCl2 + H2
Câu 10: Hoà tan một lượng oxit kim loại hoá trị II vào một lượng dung dịch H2SO4 20% vừa đủ để tạo thành dung dịch muối sunfat 22,64%. Tìm công thức của oxit kim loại đó.
A. MgO.
B. ZnO.
C. CuO.
D. FeO.
Lời giải:
Đáp án đúng là: A
Gọi công thức oxit kim loại là RO có số mol là 1 mol
RO + H2SO4 → RSO4 + H2O
1…….1…………1 (mol)
Khối lượng dung dịch sau phản ứng là:
mdd = mRO+ = R + 16+ 490 = R + 506 (gam)
Vậy R là Mg, công thức oxit là MgO
A. Mg
B. Ca
C. Ba
D. Zn
Lời giải:
Đáp án đúng là: B
2M + 2xH2O → 2M(OH)x + xH2
a…….a…………………….0,5xa (mol)
Theo bài ra ta có: mkim loại = Ma = 4 gam (*)
→ mdd = Ma + 96,2 – 2.0,5xa = 4 + 96,2 – xa = 100,2 – xa
Khối lượng M(OH)x = (M+17x)a = Ma + 17xa = 4 + 17xa
=>C% của M(OH)x =
=> 400 +1700xa = 741,48 – 7,4xa => xa = 0,2 (**)
Từ (*) và (**): →M = 20x
Với x = 2 thì M = 40 (thoả mãn)
Vậy M là Ca (canxi).
Lời giải:
Gọi x là số mol của Al
Gọi y là số mol của Zn
mhh = mAl + mZn = nAl. MAl + nZn. MZn = x. MAl + y. MZn = 27x + 65y
⇔ 17,05 = 27x + 65y
PTHH : 2Al + 6HCl → 2AlCl3 + 3H2 ( bay hơi )
2 : 6 : 2 : 3 (mol)
x → 3x ( mol)
PTHH: Zn + 2HCl → ZnCl2 + H2 ( bay hơi )
1 : 2 : 1 : 1 (mol)
y → 2y ( mol)
⇒nHCl = nHCl ở pt ( 1 ) + nHCl ở pt ( 2 )
⇔0,8 = 3x + 2y (4)
Từ (3) và ( 4) => x ≈ 0,1 ( mol) , y ≈ 0,2 (mol)
MZn = n. M = 0,2. 65 = 13 (gam )
A. Fe2(SO4)3.9H2O
B. Fe2(SO4)3
C. CuSO4.6H2O
D. CuSO4.
Lời giải:
Đáp án đúng là: A
M2On + nH2SO4 → M2(SO4)n + nH2O
Nếu có 1 mol M2On thì số gam dung dịch H2SO4 10% là: 980n.
Số gam dung dịch muối là (2M + 996n).
Vậy oxit là Fe2O3
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Nếu hiệu suất là 100% thì số mol muối = số mol oxit = 0,02.
Vì hiệu suất là 70% nên số mol muối = 0,02.70%=0,014.
Số gam Fe2(SO4)3 = 0,014.400=5,6 < 7,868.
Vậy muối là: Fe2(SO4)3.xH2O
Ta có: (400 + 18x).0,014= 7,868 x=9
Công thức muối: Fe2(SO4)3.9H2O
Câu 14: Hòa tan hoàn toàn 8,3 gam hỗn hợp Al và Fe bằng lượng dư dung dịch HCl, sau phản ứng thu được 5,6 lít khí H2 ở đktc và dung dịch X
a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu
b) Cô cạn dung dịch X thu được m gam muối khan. Tính m
Lời giải:
a)2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
Hỗn hợp: Al (a mol), Fe (b mol)
%mFe =100 − 32,53 = 67,47%
b)
Câu 15: Hòa tan m gam K vào 200 gam nước thu được 200 ml dung dịch có nồng độ là 2,748%. Vậy m có giá trị là?
Lời giải:
Gọi số mol K là x
2K + 2H2O → 2KOH + H2
Suy ra m = 39x
BTKL:
mdd sau phản ứng = = 39x + 200 − 0,5x.2 = 200 + 38x
nK = nKOH = x mol
Câu 16: Hỗn hợp Al và Fe3O4 đem nung không có không khí. Hỗn hợp sau phản ứng nhiệt nhôm nếu đem tác dụng với NaOH dư thu được 6,72 lít H2, nếu đem tác dụng với dung dịch HCl diw thu được 26,88 lít H2. Khối lượng Al trong hỗn hợp ban đầu là:
A. 27 g;
B. 2,7 g;
C. 54 g;
D. 5,4 g.
Lời giải:
Đáp án đúng là: A
8Al + 3Fe3O4 → 9Fe + 4Al2O3
Sau phản ứng hỗn hợp gồm Al dư; Al2O3; Fe dư và Fe3O4 dư.
Cho tác dụng với NaOH chỉ có Al dư và Al2O3 phản ứng
NaOH + Al + H2O → NaAlO2 + 3/2H2
2NaOH + Al2O3 → 2NaAlO2 + H2O
Nếu cho hỗn hợp tác dụng với HCl thì chỉ có Al và Fe sinh ra H2
Al + 3HCl → AlCl3 + 3/2 H2
Fe + 2HCl → FeCl2 + H2
Theo phản ứng → nAl phản ứng = 8/9nFe = 0,8 mol
→ nAl tham gia = 0,2 + 0,8 = 1 mol
→ mAl ban đầu = 1.27 = 27 gam.
Lời giải:
Đặt số mol mỗi chất trong X là x.
⇒ 84x + 111x + 208x = 40,3
⇔x = 0,1 (mol)
K2O + H2O → 2KOH
⇒nKOH = 0,12.2 = 0,24 (mol)
2NaHCO3 + 2KOH → K2CO3 + Na2CO3 + 2H2O
⇒ dư 0,24 − 0,1 = 0,14 mol KOH
Gọi chung 2 muối BaCl2, CaCl2 là MCl2 (0,2 mol)
MCl2 + R2CO3 → 2RCl + MCO3
nRCl = 0,1.2 = 0,2 (mol)
Lời giải:
Lời giải:
Áp dụng định luật bảo toàn khối lượng, ta có:
PTHH: 2M + Cl2 → 2MCl
→ 2 kim loại X, Y lần lượt là Na, Li
Gọi số mol Na, Li lần lượt là x, y (mol)
Ta có hệ:
A. 16,24 gam
B. 23,2 gam
C. 20,88 gam
D. 46,4 gam
Lời giải:
Đáp án đúng là: C
Gọi n(NO2) = a và n(NO) = b. → a + b = 0,05 và 46a + 30b = 0,05. 19,8. 2
→ a = 0,03 và b = 0,02
Gọi n(FeO) = n(Fe3O4) = n(Fe2O3) = a
→ n(Fe) = a + 3a + 2a = 6a và n(O trong X) = a + 4a + 3a = 8a
BT e, ta có: 18a = 0,06 + 0,03 + 16a → a = 0,045 mol
→ m = 6. 0,045. 56 + 8. 0,045. 16 = 20,88 (g).
Câu 21: Hỗn hợp A gồm Al2O3 và Fe2O3. Dẫn khí CO qua 10,55 gam A và nung nóng thu được hỗn hợp rắn B gồm 5 chất và hỗn hợp khí D. Dẫn D qua dung dịch Ca(OH)2 dư có 2,5 gam kết tủa. Đem hỗn hợp B tác dụng vừa đủ với 0,5 lít dung dịch H2SO4 loãng 0,5 M thì có 1,12 lít khí thoát ra (đktc). Viết phương trình hóa học xảy ra và tính % khối lượng mỗi chất trong hỗn hợp A.
Lời giải:
CO2 + Ca(OH)2 → CaCO3 + H2O
Fe + H2SO4 → FeSO4 + H2
FeO + H2SO4 → FeSO4 + H2O
Fe3O4 + 4H2SO4 → Fe2(SO4)3 + 4H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Gọi x, y là số mol Al2O3; Fe2O3
⇒102x + 160y = 10,55 (1)
Bảo toàn nguyên tố H:
Bảo toàn nguyên tố C:
Bảo toàn nguyên tố O:
Từ (1) và (2)
Lời giải:
Mà được trộn theo tỉ lệ 1 : 2 nên
Ankan 1 = 0,05
Ankan 2 = 0,1
Ta có:
→ C2H6 và CnH2n+2
Bảo toàn C: 0,05.2 + n.0,1 = 0,4
→ n = 3 → C3H8
Vậy C2H6 và C3H8
→ % Ankan 2 = 100% - 33,33% = 66,67 %.
Câu 23: Hỗn hợp bột gồm Fe, Cu, Ag, Al hóa chất duy nhất dùng tách Ag sao cho khối lượng không đổi là
A. AgNO3;
B. Fe(NO3)2;
C. Fe(NO3)3;
D. HNO3 loãng.
Lời giải:
Đáp án đúng là: C
A. dùng dd AgNO3 thì sẽ làm lượng Ag trong hỗn hợp tăng lên
B. dùng dd Fe(NO3)2 thì sẽ không tinh chế được Ag vì cả Ag và Cu cùng không phản ứng với dd Fe(NO3)2
C. Dùng dd Fe(NO3)3 sẽ tinh chế được Ag mà không làm thay đổi khối lượng của chúng
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2Fe(NO3)3 + Cu → 2Fe(NO3)2 + Cu(NO3)2
3Fe(NO3)3 + Al → Al(NO3)3 + 3Fe(NO3)2
D. Không dùng được vì Ag cũng sẽ phản ứng.
Lời giải:
Không khí có 80% thể tích là N2; 20% là O2 nên gọi:
PTHH:
Bđ: a a
Pư: 2x x 2x
Sau: a-2x a-x 2x
Bảo toàn khối lượng: mA = mB → nA.MA = nB.MB
→ Hiệu suất tính theo SO2
a) Tính số mol mỗi khí trong hỗn hợp Y.
b) Tính khối lượng của kết tủa Y.
Lời giải:
Đặt a, b lần lượt là số mol của CO2, CO.
Theo đề bài ra, ta có:
PTHH: CO2 + Ca(OH)2 → CaCO3 + H2O
0,04………………0,04 (mol)
Câu 26: Hỗn hợp T gồm 2 kim loại X và Y ở 2 chu kì liên tiếp của nhóm IIA, MX < MY. Lấy 0,88 gam hỗn hợp T cho hòa tan hoàn toàn trong dung dịch HCl dư, thu được 0,03mol H2 và dung dịch Z. Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và 2 kim loại x và y là
A.3,01 g; Mg và Ca;
B.2,95 g; Be và Mg;
C. 3,01 g; Ca và Sr;
D. 2,95 g; Mg và Ca.
Lời giải:
Đáp án đúng là: A
Bảo toàn e:
Vì 24 < 29,33 < 40 nên hai kim loại là Mg và Ca
BTKL: m = 0,88 + 0,06.36,5 − 0,03.2 = 3,01 gam.
Lời giải:
Đặt nA = 3a (mol);nB = a (mol)
Mà A, B cùng dãy đồng đẳng nên MB = MA + 14x (x: số tự nhiên khác 0)
→3MA + MA + 14x = 148
→x = 2; MA = 30 (C2H6) hoặc x = 6; MA =16 (CH4)
Vậy các hidrocacbon có thể là:
- Phần 1 cho tác dụng với NaOH dư, sau phản ứng hu được 1,68 lít khí và 12,6 gam chất rắn.
- Phần 2 cho tác dụng với dd H2SO4 đặc nóng dư, sau phản ứng thu được 27,72 lít khí SO2 và dd Z có chứa 263,25 gam muối SO4. Biết các phản ứng xảy ra hoàn toàn, thể tích các khí đo ở đktc.
a) Viết các PTHH.
b) Tính m và xác định CTHH của FexOy.
Lời giải:
Y có Al2O3, Fe và Al dư
Ta có:
Phần 1: Cho tác dụng với NaOH dư
Al2O3 + 2NaOH → 2NaAlO2 + H2O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
→mAl dư = 1,35 (g)
→mFe = 12,6 (g) →nFe = 0,225 (mol)
Phần 2: cho tác dụng với dung dịch H2SO4 đặc nóng dư
Gọi a là hệ số tỉ lệ với phần 1
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O (1)
2Al + 6 H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O (2)
2Fe + 6H2SO4→ Fe2(SO4)3 + 3SO2 + 6H2O (3)
→ nAl = 0,05a mol
→nFe = 0,225a mol
mphần 2 = 0,3.102 + 0,05.3.27 + 0,225.3.56 = 72,45 (g)
Mà ta lại có phần 2 gấp 3 lần phần 1 nên suy ra:
→ mphần 1 = mphần 2 = 24,15 (g) →m = mphần 1 + mphần 2 = 96,6 (g).
phần 2 = 0,4 (mol)
nFe ban đầu = 4nFe (phần 1) = 0,9 (mol)
→Fe3O4.
Câu 29: Hỗn hợp X gồm C3H4, C3H6, C3H8 có tỉ khối so với H2 là 21. Đốt cháy hoàn toàn 1,12 lít hỗn hợp X (đktc), rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư, lọc bỏ kết tủa, khối lượng dung dịch thu được so với khối lượng nước vôi trong ban đầu
A. giảm 5,7 gam;
B. giảm 15 gam;
C. tăng 9,3 gam;
D. giảm 11,4 gam.
Lời giải:
Đáp án đúng là: A
Đề cho hỗn hợp X gồm 3 chất, nhưng chỉ có 2 giả thiết liên quan đến các chất đó nên quy đổi hỗn hợp X thành hỗn hợp gồm C3H6, C3H8
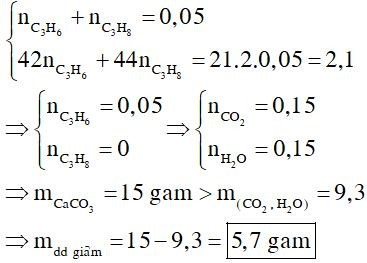
Lời giải:
A = P + N = Z + N
Số N hơn kém nhau 2 tức A hơn kém nhau 2 .
Gọi đồng vị nhỏ hơn là A1 (90%)
→ đồng vị lớn A2 = A1 + 2 (1)
A2 = 100 – 90 = 10%
A trung bình = 40,08 = 0,9A1+0,1A2 (2)
Từ (1) và (2) →A1 = 39,88, A2 = 41,88
Vậy A1 = 40; A2 = 42.
Câu 31: Tại sao hơi nước là chất tinh khiết?
Lời giải:
- Ta biết: Chất tinh khiết là chất không lẫn chất khác, hoặc chỉ có 1 nguyên tố hay là 1 hợp chất không thành phần của hợp chất hoặc nguyên tố khác và nó có tính chất nhất định, không thay đổi.
⇒ Rõ ràng hơi nước là chất tinh khiết vì là trạng thái khí của nước. Nó là một trong những pha của nước trong thủy quyển, vì vậy nó cũng giống nước, không pha lẫn tạp chất khác và có tính chất nhất định.
Lời giải:
Gọi tổng số hạt trong A, B, X lần lượt là a, b, c
Ta có hpt:
Áp dụng CT:
vào từng nguyên tử
+ Xét nguyên tử A:
→ A là C
+ Nguyên tử B:
→ B là N hoặc O
- B là N thì AB2 là CN2 (loại)
- B là O thì AB2 là CO2 (thoả mãn)
Do MZ < 120 thì Z chỉ chứa 1 nhóm CO3
→ Z là X2CO3 hoặc XCO3
Mà X hình thành hợp chất XO nên X hoá trị II → Z là XCO3
- ZX = 18 thì Z là Ar (loại)
- ZX = 19 thì Z là K (loại)
- ZX = 20 thì Z là Ca (thoả mãn).
Lời giải:
Vậy CTHH: Al2(SO4)3.
Lời giải:
%H = 100% - 82,76% = 17,24%
Gọi công thức tổng quát là CxHy
Lập tỉ lệ, ta được:
Vậy công thư đơn giản của X là C2H5.
Câu 35: Hợp chất hữu cơ Y ( chứa C, H, O) có công thức phân tử trùng với công thức đơn giản nhất. Đốt cháy hoàn toàn 1,48 gam Y rồi dẫn hỗn hợp sản phẩm cháy lần lượt đi qua bình thứ nhất đựng dung dịch H2SO4 đặc dư, bình thứ hai đựng dung dịch KOH dư. Sau thí nghiệm, khối lượng bình thứ nhất tăng 0,72 gam và bình thứ hai tăng 3,96 gam.
(a) Viết công thức cấu tạo và gọi tên của Y. Biết rằng Y không có phản ứng tráng bạc, Y phản ứng với dung dịch KMnO4 loãng, lạnh tạo ra chất hữu cơ Y1 có khối lượng MY1 = MY +34. Cứ 1,48 gam Y phản ứng vừa hết với 20 ml dung dịch NaOH 1M và tạ ra hai muối.
(b) Hợp chất hữu cơ Z là đồng phân của Y. Viết công thức cấu tạo của Z, biết rằng 0,37 gam Z phản ứng vừa hết với 25 ml dung dịch NaOH 0,1M, dung dịch tạo ra phản ứng với lượng dư dung dịch AgNO3/NH3 đến hoàn toàn, thu được 1,08 gam Ag kim loại. Z chỉ phản ứng với H2/Pd, t0 theo tỉ lệ mol 1: 1.
Lời giải:
a) Gọi CTPT của Y là CxHyOz ( x, y, z € N*)
Đốt cháy Y sản phẩm thu được gồm H2O và CO2. Khi cho sản phẩm qua H2SO4 đặc dư thì H2O bị hấp thụ, tiếp tục cho qua KOH dư thì CO2 bị hấp thụ
→ mB1 tăng = = 0,72 (g) → = 0,72/18 = 0,04 (mol)
mB2 tăng = = 3,96 (g) → = 3,96/44 = 0,09 (mol)
BTKL: nO (trong A) = (mA – mC – mH )/16 = (1,48 – 0,09.12 – 0,04.2 )/16 = 0,02 (mol)
Ta có: x : y : z = nC : nH : nO
= 0,09 : 0,08 : 0,02
= 9 :8 : 2
CTPT trùng với CT ĐGN => CTPT củaY là: C9H8O2
Độ bất bão hòa của Y: C9H8O2: k = ( 9.2 + 2 – 8) /2 = 6
Y không tham gia phản ứng tráng bạc => Y không có cấu tạo nhóm – CHO trong phân tử
Y + KMnO4 → Y1 ( MY1 = MY + 34 ) => Y có chứa liên kết đôi C=C khi phản ứng với KMnO4 sẽ tạo thành C(OH)-C(OH)
nY = 1,48: 148 = 0,01 (mol) ; nNaOH = 0,02 (mol)
nY : nNaOH = 1: 2 và sản phẩm tạo thành 2 muối => Y là este của axit cacboxylic và phenol hoặc dẫn xuất của phenol
Vậy CTCT của Y thỏa mãn là: CH2=CH-COOC6H5: phenyl acrylat
3CH2=CH-COOC6H5 + 2KMnO4 + 4H2O → 3CH2(OH)-CH(OH)-COOC6H5 + 2MnO2↓ + 2KOH
b) Z là đồng phân của Y => Z có cùng CTPT là: C9H8O2
nZ = 0,37/148 = 0,025 (mol); nNaOH = 0,025 (mol); nAg = 0,01 (mol)
nZ : nNaOH = 1: 1 => Z có 1 trung tâm phản ứng với NaOH
Ta thấy nAg = 4nZ => Z phải phản ứng với NaOH sinh ra cả 2 chất hữu cơ đều có khả năng tham gia phản ứng tráng bạc ( mỗi chất tham gia phản ứng tráng bạc sinh ra 2Ag)
Z chỉ phản ứng với H2 ( Pb, t0) theo tỉ lệ 1: 1 => Z có 1 liên kết đôi C=C ngoài mạch
Vậy CTCT của Z thỏa mãn là: HCOOCH=CH-C6H5
HCOOCH=CH-C6H5 + NaOH → COONa + C6H5CH2CHO
HCOONa + 2AgNO3 + 3NH3 + H2O → NH4O-COONa + 2Ag ↓ + 2NH4NO3
C6H5CH2CHO + 2AgNO3 + 3NH3 + H2O → C6H5CH2COONH4+ 2Ag↓ + 2NH4NO3
Câu 36: Hợp chất khí với hiđro của nguyên tố R là RH2. Trong oxit cao nhất, tỉ lệ khối lượng giữa R và oxi là 2 : 3. Nguyên tố R là
A. Ca;
B. Se;
C. S;
D. Mg.
Lời giải:
Đáp án đúng là: C
Từ hợp chất RH2 → R thuộc nhóm VIA nên hợp chất với oxit cao nhất là: RO3
Ta có: → R = 32 nên R là nguyên tố S.
Câu 37: Hợp chất khí với hidro của nguyên tố R là RH4. Oxit cao nhất của nó chứa 53,33% oxi về khối lượng. Nguyên tố R là
A. C.
B. Si.
C. Pb.
D. S.
Lời giải:
Đáp án đúng là: B

Lời giải:
+) Hợp chất M2X có tổng số hạt cơ bản là 140
⇒2(2ZM + NM) + (2ZX + NX) = 140
⇔(4ZM + 2NM) + (2ZX + NX) = 140 (1)
+) Trong số đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44
→(4ZM + 2ZX) − (2NM + NX) = 44 (2)
+) Số hạt mang điện của M nhiều hơn của X là 22
→2ZM − 2ZX = 22 (3)
Giải (1), (2) ta được:
Từ (3), (4) ⇒
Câu 39: Hợp chất trong đó sắt chiếm 70% khối lượng là hợp chất nào trong số các hợp chất sau?
A: FeS;
B: Fe3O4;
C: FeO;
D: Fe2O3.
Lời giải:
Đáp án đúng là: D
Lời giải:
- Tổng hạt trong A2B: 2(2Z+N) + (2Z'+N') = 92 (1)
- Hạt mang điện nhiều hơn không mang điện là 28: (2.2Z+2Z') - (2N+N') = 28 (2)
- Hạt "mang điện" trong nhân A hơn nhân B là 6 hạt: Z - Z' = 6 (3)
Cộng hai vế (1) và (2) được: 8Z + 4Z' = 120 (4)
Giải hệ (3) và (4) được Z = 12 (Mg) và Z' = 6 (C)
Vậy công thức của hợp chất là Mg2C.
Câu 41: Hợp chất X có thành phần phần trăm theo khối lượng 28% Fe, 24% S còn lại là oxi.
a) Tìm công thức phân tử của hợp chất X. Biết khối lượng mol của X là 400 g/mol.
b) Ở điều kiện tiêu chuẩn, cần bao nhiêu lít oxi thì có số phân tử đúng bằng số nguyên tử có trong 20 gam hợp chất X.
Lời giải:
a) %O = 100% - 28% - 24% = 48%
Đặt CTHH hợp chất X là FexSyOz
Ta có:
→ CTHH hợp chất X có dạng (Fe2S3O12)n với
Mà MX = 400 nên ta có:
(56.2 + 32.3 + 16.12).n = 400 → n = 1
b,
Một phân tử Fe2S3O12 có 2+3+12 = 17 nguyên tử
nên 0,05 mol X có 0,05.17 = 0,85 mol nguyên tử
Số phân tử O2 bằng số nguyên tử trong 20 gam X nên số mol O2 bằng số mol nguyên tử trong 20 gam X
Vậy = 0,85.22,4 = 19,04 (l).
Lời giải:
Hợp chất tạo bởi Cu; O có dạng là CuxOy.
= 64x + 16y = 144
Vậy hợp chất cần tìm là Cu2O.
a. Biết tỉ khối hơi của A so với H2 là 23. Tìm CTPT của A.
b. Viết CTCT có thể có của A.
Lời giải:
CTHH: CxHyOz
b)C2H6O có 2 đồng phân: CH3 – CH2 – OH; CH3 – O − CH3
Câu 44: Hợp chất hữu cơ X có phần trăm khối lượng %C= 55,81%, %H=6,98% , còn lại là oxi
a, Lập công thức đơn giản nhất của X
b, Tìm CTPT của X, biết tỉ khối hơi của X số với nitơ xấp sỉ bằng 3,07.
Lời giải:
%mO = 100% − 55,81% − 6,98% = 37,21%
Hợp chất tạo bởi C; H; O nên có dạng CxHyOz
Vậy công thức đơn giản nhất là C2H3O
CTPT của X có dạng (C2H3O)n
Vậy X là C4H6O2.
Câu 45: Viết phương trình ion rút gọn của phương trình sau: Fe + HCl?
Lời giải:
Phương trình ở dạng phân tử: Fe + 2HCl → FeCl2 + H2
Phương trình dạng ion đầy đủ:
Phương trình dạng ion rút gọn :
Câu 46: Làm sao để biết các ion là axit, bazo, trung tính hay lưỡng tính?
Lời giải:
Một chất là axit khi nó có thể nhường proton. Một chất là bazơ khi nó có thể nhận proton. Khi có cả hai tính chất trên thì là chất lưỡng tính, còn lại là các chất trunh tính.
- ion axit: ion của kim loại trung bình yếu,
- ion bazơ: ion gốc axit trung bình yếu.
- ion lưỡng tính:
- ion trung tính: còn lại.
Lưu ý: không phải cứ có H là ion lưỡng tính.
Câu 47: Trong hóa học hữu cơ khi nào dùng iso, neo, sec, tert?
Lời giải:
Những gốc hidrocacbon có 1 nhánh CH3 ở C2 gọi là iso
VD: CH3 - CH(CH3) – CH2 - : gốc isobutyl
Những gốc hidrocacbon có 2 nhánh CH3 ở C2 gọi là neo
VD: CH3 -(CH3)C(CH3) – CH2 -: gốc neopentyl
Những gốc hidrocacbon mà vị trí gắn nhóm chức là C bậc II gọi là sec
VD: CH3-CH2-CH(CH3)-: gốc sec-butyl
Những gốc hidrocacbon mà vị trí gắn nhóm chức là C bậc IIi gọi là tert
VD: CH3 - (CH3)C(CH3)-: gốc tert-butyl
a/Tính phần trăm khối lượng từng kim loại trong hỗn hợp ban đầu.
b/ Cô cạn dung dịch và nung đến khối lượng không đổi.Tính thể tích khí sinh ra ở đktc, biết H= 80%
Lời giải:
Gọi nCu = x (mol), nZn = y (mol);
Cho 3,89 gam hỗn hợp Cu và Zn → 64x + 65y = 3,89 (*)
Cu + 2HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (1)
Zn + 2HNO3 → Zn(NO3)2 + 2NO2 + 2H2O (2)
Theo PTHH: (1)
(2):
(**)
Từ (*), (**), ta có hệ phương trình:
a/ Phần trăm khối lượng từng kim loại trong hỗn hợp ban đầu
%mZn = 100% - 16,45% = 83,55%.
Câu 49: Khi cho 5,1 (g) oxit kim loại M nhóm IIIA tác dụng hoàn toàn với dung dịch HCl 20% thu được 6,675 (g) muối clorua.
a) Xác định tên kim loại M.
b) Tính khối lượng dung dịch HCl đã dùng.
Lời giải:
a) PTHH: M2O3 + 6HCl → 2MCl3 + 3H2O
Vậy M là nhôm (Al)
b)
A. H2, NO2;
B. H2, NH3;
C. N2, N2O;
D. NO, NO2.
Lời giải:
Đáp án đúng là: B
Trong môi trường kiềm, bị Al, Zn khử thành NH3
Trong môi trường axit, bị nhiều kim loại khử thành nhiều sản phẩm khử như NO2, NO, N2O N2,
Zn + 2NaOH → Na2ZnO2 + H2
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
4Zn + NaNO3 + 7NaOH → 4Na2ZnO2 + NH3 + 2H2O
8Al + 3NaNO3 + 5NaOH + 2H2O → 8NaAlO2 + 3NH3