Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học (Phần 4)
Câu 1: Phân tử M2O nặng hơn phân tử hiđro 47 lần. Nguyên tử khối của M bằng bao nhiêu?
A. 23.
B. 39.
C. 40.
D. 24.
Lời giải:
Lời giải:
a, Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
b, Fe + H2SO4 → FeSO4 + H2
c, Fe thụ động với H2SO4 đặc nguội.
d, Fe không tác dụng với ZnSO4 vì Zn hoạt động hóa học mạnh hơn Fe.
Câu 3: Hoà tan 1,15 gam Na vào nước dư
a) Viết phương trình phản ứng xảy ra.
b) Tính khối lượng NaOH tạo thành và thể tích H2 (đktc).
c) Dẫn toàn bộ lượng khí hiđro trên qua ống nghiệm chứa CuO đun nóng. Tính khối lượng Cu thu được?
Lời giải:
a) Phương trình phản ứng xảy ra:
2Na + 2H2O → 2NaOH + H2↑
Theo phương trình, ta có:
nNaOH = nNa = 0,05 (mol) → mNaOH = 0,05. 40 = 8 (g)
c) Phương trình phản ứng:
Theo phương trình:
Lời giải:
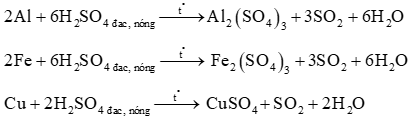
Lượng 3 muối sunfat = 45,1.2 = 90,2 gam và số mol SO2 = 0,7 mol
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Kết tủa lọc được chỉ còn Fe(OH)3 và Cu(OH)2
12.2 = 24 (gam) là tổng lượng 2 oxit Fe2O3 + CuO
Gọi x, y, z lần lượt là số mol của Fe, Al, Cu
Ta có hệ 3 phương trình:
Giải hệ cho x = 0,2; y = 0,2; z = 0,1
Suy ra khối lượng mỗi kim loại trong hỗn hợp ban đầu:
mFe = 11,2 g;
mAl = 5,4 g;
mCu = 6,4 g.
a) Viết các phương trình hóa học xảy ra
Lời giải
Gọi kim loại là R
a, Các phương trình hoá học xảy ra:
2R + 2H2O → 2ROH + H2
ROH + HCl → RCl + H2O
b, nHCl = 2. 0,1 = 0,2 mol
ROH + HCl → RCl + H2O
0,2 …... 0,2
2R + 2H2O → 2ROH + H2
0,2……………0,2
→nR = 0,2 mol
→ R là Na
Vậy kim loại là Na.
Lời giải:
Kim loại thuộc nhóm IA nên có hoá trị I.
Đặt hai kim loại trong hỗn hợp tương đương với một kim loại là M.
Ta có:
Phản ứng xảy ra:
2M + 2H2O → 2MOH + H2
0,2………………………0,1
Vì 2 kim loại thuộc 2 chu kì liên tiếp, nguyên tử khối trung bình là 30 nên kim loại thỏa mãn là Na và K.
(b) Tính m và khối lượng muối có trong dung dịch X.
Lời giải:
a) Ta có:
Phương trình phản ứng: 2R + 6HCl → 2RCl3 + 3H2
Vậy R là nhôm (Al)
b)
Lời giải:
Trong R gọi số hạt proton là pR
Trong X gọi số hạt proton là pX
Vì số hạt mang điện trong hạt nhân R và X đều bằng số hạt không mang điện nên :
nR = pR; nX = pX
Tổng số hạt trong RX2 là 96:
(2pR + nR) + 2. (2pX + nX) = 96
⇔ (2pR + pR) + 2. (2pX + pX) = 96
⇔ 3pR + 6pX = 96 (1)
Mà số hạt mang điện trong R nhiều gấp hai trong X:
2pR = 4pX (2)
Từ (1) và (2) suy ra pR = 16 (Lưu huỳnh); pX = 8 (Oxi)
Vậy CTHH của hợp chất cần tìm là SO2.
Câu 9: Từ một dung dịch có pH = 6 muốn tạo thành dung dịch có pH < 6 thì phải cho vào dung dịch đó:
A. Một ít muối ăn;
B. Một ít nước;
C. Một ít bazơ;
D. Một ít axit
Lời giải:
Đáp án đúng là: D
Khi thêm một ít axit vào dung dịch thì nồng độ H+ trong dung dịch sẽ tăng, đồng thời làm giảm độ pH.
Câu 10: Cho phương trình hoá học sau SO3 + H2O → H2SO4. Chất tham gia là:
A. SO3, H2SO4;
B. H2SO4;
C. H2O, H2SO4;
D. SO3, H2O.
Lời giải:
Đáp án đúng là: D
Chất tham gia trong phương trình trên là: SO3, H2O.
b) Tính Vdd HCl 0,2M cần để hòa tan hết kim loại này.
Lời giải:
a)
Gọi hoá trị của M là n ()
Phương trình: 2M + 2nHCl → 2MCln + nH2
Xét n = 1 → MM = 32,5 (g/mol) (Loại)
Xét n = 2 → MM = 65 (g/mol) (Nhận)
Xét n = 3 → MM = 97,5 (g/mol) (Loại)
Vậy M là kẽm (Zn)
b) Phương trình: Zn + 2HCl → ZnCl2 + H2
Câu 12: Bằng phương pháp hóa học hãy phân biệt các khí CO2, N2, NH3, SO2?
Lời giải:
- Cho các khí tác dụng với quỳ tím ẩm:
+ Quỳ tím chuyển đỏ: CO2, SO2 (1)
CO2 + H2O ⇌ H2CO3
SO2 + H2O ⇌ H2SO3
+ Quỳ tím chuyển màu xanh: NH3
NH3 + H2O ⇌ NH4OH (hay NH4+ + OH-)
+ Quỳ tím không đổi màu: N2
- Cho 2 khí ở (1) đi qua dung dịch Br2:
+ Dung dịch nhạt màu dần: SO2
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
+ Không hiện tượng: CO2
Câu 13: Dung dịch Cu(NO3)2 có màu gì?
A. Tím;
B. Vàng nhạt;
C. Xanh lam;
D. Đỏ nâu.
Lời giải:
Đáp án đúng là: C
Dung dịch Cu(NO3)2 có màu xanh lam.
Lời giải:
0,1……0,1
pH = 14 – pOH = 14 – 1 = 13
Lời giải:
Vì nên kết tủa chưa cực đại → Có các trường hợp sau:
- Trường hợp 1: Ba(OH)2 dư nên muối tạo thành chỉ có BaSO3
PTHH: SO2 + Ba(OH)2 → BaSO3↓ + H2O
- Trường hợp 2: SO2 hết nhưng đã hoà tan 1 phần kết tủa
PTHH: SO2 + Ba(OH)2 → BaSO3 + H2O (1)
0,15….0,15……….0,15 (mol)
Theo (1) thì = 0,15 mol, nhưng theo đề thì = 0,11 mol nên bị hoà tan: 0,15 – 0,11 = 0,04 (mol)
SO2 + H2O + BaSO3 → Ba(HSO3)2 (2)
0,04…………0,04 (mol)
Câu 16: Axit tương ứng của oxit axit SO2 là:
A. H2SO3;
B. H2SO4;
C. HSO3;
D. SO3.2H2O.
Lời giải:
Đáp án đúng là: A
SO2 + H2O ⇌ H2SO3
Câu 17: Cu có tác dụng được với NaOH không? Vì sao?
Lời giải:
Cu không tác dụng với NaOH, vì NaOH là bazơ không hoà tan các kim loại như Cu, Fe …
Lời giải:
Khối lượng bình tăng là khối lượng của CO2 và H2O hấp thụ vào bình.
Phương trình:
Áp dụng định luật bảo toàn khối lượng, ta có:
Vậy a = 5,72 gam.
Lời giải:
nH+ = 2.0,04.0,375 = 0,03 mol;
nOH- = 0,16.(0,16 + 0,04) = 0,032 mol;
H+ + OH- → H2O
→ pH = 14 – pOH = 14 + log0,01 = 12
Lời giải:
Vì CO không tác dụng được với Ba(OH)2 bởi nó là oxit trung tính nên chỉ có phản ứng giữa CO2 với Ba(OH)2
Nếu tạo BaCO3 thì →
Nếu tạo Ba(HCO3)2 thì
Theo đề: 39,4 < 42,5 < 51,8 → Tạo cả 2 muối.
CO2 + Ba(OH)2 → BaCO3 + H2O
a………a…………..a
2CO2 + Ba(OH)2 → Ba(HCO3)2
2b……..b……………b

Câu 21: Tính hóa trị của nhóm HCO3 trong hợp chất Ca(HCO3)2?
Lời giải:
Gọi hoá trị của nhóm HCO3 trong hợp chất Ca(HCO3)2 là a (a > 0)
Áp dụng quy tắc hoá trị, ta có: II.1 = a.2 → a = I
Vậy hoá trị của nhóm HCO3 trong hợp chất Ca(HCO3)2 là I.
Lời giải:
nAl = 0,02 mol; nNaOH = 0,04 mol
Các phương trình phản ứng:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (1)
0,02….0,02………………..0,02
nNaOH dư = 0,04 – 0,02 = 0,02 (mol) nên dung dịch X gồm 0,02 mol NaOH và 0,02 mol NaAlO2.
Cho từ từ HCl vào X:
NaOH + HCl → NaCl + H2O (2)
0,02……0,02 mol
NaAlO2 + HCl + H2O → NaCl + Al(OH)3↓ (3)
0,02……….0,02 mol
Al(OH)3 + 3HCl → AlCl3 + 3H2O (4)
Để thu được kết tủa lớn nhất thì phản ứng chỉ dừng ở (3).
nHCl = nHCl (2) + nHCl (3) = 0,04 mol
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: C
Ta có: p + e + n = 21 → 2p + n = 21→ n = 21 – 2p
Mặt khác, vì
+ Trường hợp 1: e = p = 6
Cấu hình electron: 1s22s22p2 → có 3 phân lớp electron.
+ Trường hợp 2: e = p = 7
Cấu hình electron là: 1s22s22p3 → có 3 phân lớp electron.
Câu 24: Viết phương trình phân tử và ion rút gọn: Ba(NO3)2 + Na2SO4→?
Lời giải:
Phương trình phân tử: Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
Phương trình ion rút gọn:
Lời giải:
Cho từ từ HCl vào hỗn hợp Na2CO3 và NaHCO3 lần lượt xảy ra 2 PTHH sau:
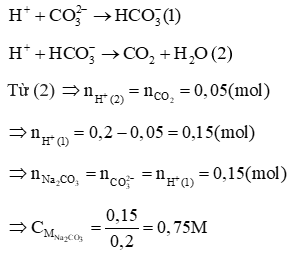
Lời giải:
2K + 2HCl → 2KCl + H2
R + 2HCl → RCl2 + H2
Gọi số mol của K, R là x; y
Ta có:
→ 34,8 là giá trị trung bình của MR và MK = 39 nên MR < 34,8 (1)
Mà R + 2HCl → RCl2 + H2
(2)
Từ (1), (2), có: 18,3 < MR < 34,8 mà R là kim loại hoá trị II nên R là magie (Mg).
Lời giải:
Cấu hình electron nguyên tử của X: 1s22s22p63s23p6 . Nguyên tố X ở ô số 18, chu kì 3, nhóm VIIIA. Đây là một nguyên tố khí hiếm (Ar) có cấu hình electron nguyên tử bền vững nên không tồn tại hợp chất của X trong đó X tồn tại ở dạng ion.
A. 0,5;
B. 0,025;
C. 0,1;
D. 0,05.
Lời giải:
Đáp án đúng là: B
nHCl = 0,05. 0,3 = 0,015 (mol)
Sau khi trộn, pH = 2 chứng tỏ axit còn dư
pH = 2 thì suy ra
Vậy: 0,015 - 0,4x = 0,005 nên x = 0,025 M
Lời giải:
Gọi CTHH của hai oxit là A2On và B2Om (1 ≤ n, m ≤ 3)
Cho X vào dung dịch H2SO4 loãng (vừa đủ), không có khí thoát ra, tạo dung dịch chỉ chứa một chất tan. Suy ra, A chứa một oxit bị khử bởi CO (tan trong H2SO4 loãng), và một oxit không bị khử bởi CO.
Giả sử oxit bị CO khử là A2On
(1)
Ca(OH)2 + CO2 → CaCO3 + H2O (2)
B2Om + mH2SO4 → B2(SO4)m + mH2O (3)
Theo PTHH (2)
Theo PTHH (1)
mà mA = 0,96 gam nên:
Vì n là hóa trị của kim loại nên 1 ≤ n ≤ 3
+ n = 1→ MA = 32 → Loại
+ n = 2 → MA = 64→ A là Cu
+ n = 3 → MA = 96→ Loại
→A chứa CuO
Giả sử có 1 mol B2Om tham gia phản ứng
Theo PTHH(3):
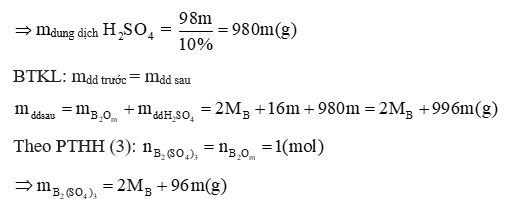
Vì dung dịch chứa muối tan có nồng độ là 11,243% nên ta có phương trình:
Vì m là hóa trị của kim loại nên 1 ≤ m ≤ 3
+ m = 1⇒ M = 9 ⇒ Loại
+ m = 2 ⇒ M = 18 ⇒ Loại
+ m = 3 ⇒ M = 27 ⇒ M là Al
→A chứa Al2O3
Vậy A gồm Al2O3 và CuO.
A. Nhóm IIA, chu kì 3;
B. Nhóm IIA, chu kì 2;
C. Nhóm IIIA, chu kì 2;
D. Nhóm IIIA, chu kì 3;
Lời giải:
Đáp án đúng là: A
Nguyên tử nguyên tố X có cấu hình electron là 1s22s22p63s2 nên ta có:
- X có 3 lớp electron nên X thuộc chu kì 3
- X có 2 electron ở lớp ngoài cùng nên X thuộc nhóm IIA.
Câu 31: Hoá trị của nguyên tố trong CH4?
Lời giải:
Trong CH4, H có hoá trị I, C có hoá trị IV (vì 1 nguyên tử C liên kết với 4 nguyên tử H).
Câu 32: Nhận biết các dung dịch NH4Cl, KCl, Na2SO4, NaNO3?
Lời giải:
- Trích các mẫu thử.
- Dùng dung dịch Ba(OH)2 cho vào các mẫu thử:
+ Mẫu thử nào tạo khí có mùi khai là NH3
PTHH: 2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + 2H2O
+ Mẫu thử nào tạo kết tủa trắng là Na2SO4
PTHH: Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
+ 2 mẫu thử còn lại không có hiện tượng gì
- Dùng dung dịch AgNO3 để nhận biết 2 mẫu thử còn lại
+ Mẫu thử nào tạo kết tủa trắng là KCl
PTHH: KCl + AgNO3 → AgCl↓ + KNO3
+ Mẫu thử còn lại là NaNO3.
Câu 33: Xác định số oxi hoá của các nguyên tử trong CH3COOH?
Lời giải
Axit axetic.
Lời giải
mmuối = mkim loại + 62.n (n là số mol e trao đổi)
→ 45,5 = 8,3 + 62.3.nNO → nNO = 0,2 (mol)
VNO = 0,2. 22,4 = 4,48 lít.
A. 35,5%;
B. 32,53%;
C. 67,17%;
D. 56,15%.
Lời giải:
Đáp án đúng là: B
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
Gọi số mol Al là x (mol, x > 0); Fe là y (mol, y > 0)
→27x + 56y = 8,3 (1)
Ta có:
Theo PTHH hoặc bảo toàn electron → 3x + 3y = 0,6 (2)
Giải (1), (2) ta được: x = y = 0,1
mAl = 2,7 gam → %mAl = 32,53%
Câu 36: Hoà tan Fe vào dung dịch HCl dư, nêu hiện tượng và phương trình hoá học.
Lời giải:
Hiện tượng: Kim loại Fe bị hoà tan, đồng thời có bọt khí không màu bay ra
PTHH: Fe + 2HCl → FeCl2 + H2↑
Câu 37: Tính thành phần phần trăm theo khối lượng của nguyên tố trong: FeO; Fe2O3
Lời giải:
MFeO = 56 + 16 = 72 (g/mol)
%mO = 100% - 77,8% = 22,2%
%mO = 100% - 70% = 30%
Lời giải:
- Trích mẫu thử.
- Dùng giấy quỳ tím kiểm tra.
+ Dung dịch nào làm giấy quỳ tím chuyển màu đỏ thì đó là dung dịch HCl
+ Dung dịch nào làm giấy quỳ tím chuyển màu xanh thì đó là dung dịch NaOH
+ Còn lại 2 dung dịch không làm quỳ tím chuyển màu.
- Cho dung dịch BaCl2 tác dụng với 2 dung dịch NaCl, Na2SO4
+ Dung dịch nào tác dụng với BaCl2 và tạo kết tủa màu trắng thì là Na2SO4
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
+ Còn lại là NaCl không tác dụng với BaCl2 nên không có hiện tượng gì xuất hiện.
Câu 39: Để xác định nguyên tố đó là kim loại, phi kim hay khí hiếm ta dựa vào cơ sở nào?
Lời giải:
Để xác định nguyên tố đó là kim loại, phi kim hay khí hiếm ta dựa vào cấu hình electron.
+ Nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là nguyên tử của nguyên tố kim loại (trừ H, He, B).
+ Nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của nguyên tố phi kim.
+ Nguyên tử có 8 electron lớp ngoài cùng là nguyên tử của nguyên tố khí hiếm.
+ Nguyên tử có 4 electron ở lớp ngoài cùng có thể là kim loại hoặc phi kim.
Lời giải
p = e = 20; n = 22
mnguyên tử = mp + me + mn = 6,9902.10 -23 gam
Giải thích các bước giải:
Nguyên tử có tổng số hạt là 62 nên: p + n + e = 62
Số khối A = p + n < 43 → p > 62 – 43 = 19
Ta có:
p ≤ n ≤ 1,5p → 3p ≤ 2p + n ≤ 3,5p → 3p ≤ 62 ≤ 3,5p
→ 17,7 ≤ p ≤ 20,67
→ 19 < p ≤ 20,67 → p = 20
→p = e = 20 ; n = 22
mnguyên tử = mp + me + mn
= 20. 1,66.10-24 + 20.9,1.10-27 + 22. 1,66.10-24
= 6,9902.10 -23 gam
Lời giải
Chỉ có 3 muối không bị thủy phân khi hòa vào nước: K2SO4, Ba(NO3)2; NaCl đều được tạo bởi cation của bazơ mạnh và anion gốc axit mạnh.
1) NH4Cl + H2O → HCl + NH4OH
2) CH3COONa + H2O → CH3COOH + NaOH
3) Na2CO3 + H2O → NaHCO3 + NaOH
4) KHSO3 + H2O → KOH + H2SO3
5) Na2HPO4 + H2O → NaOH + NaH2PO4
6) CuSO4 + 2H2O → Cu(OH)2↓ + H2SO4
7) Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3H2SO4
8) (CH3COO)2Pb + 2H2O → 2CH3COOH + Pb(OH)2
9) (NH4)2CO3 + 2H2O → 2NH4OH + H2CO3
Câu 42: Hòa tan 20,8 gam BaCl2 vào nước được 0,5 lít dung dịch. Nồng độ của ion Cl- trong dung dịch?
Lời giải
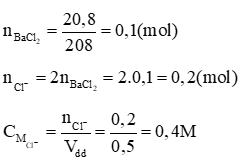
Vậy nồng độ của ion Cl- trong dung dịch là 0,4M.
Câu 43: Viết PTHH minh họa cho các tính chất sau:
a) oxit bazơ + nước → bazơ (kiềm)
b) oxit axit + bazơ → muối + nước
c) oxit bazơ + axit → muối + nước
d) kim loại + axit → muối + H2
Lời giải
a) Na2O + H2O → 2NaOH
b) CO2 + 2NaOH → Na2CO3 + H2O
c) CuO + 2HCl → CuCl2 + H2O
d) Zn + 2HCl → ZnCl2 + H2
Câu 44: Viết 1 PTHH minh họa cho mỗi tính chất hoá học của kim loại?
Lời giải
Phản ứng của kim loại với phi kim:
- Tác dụng với oxi:
- Tác dụng với phi kim khác:
Phản ứng của kim loại với dung dịch axit: 2Al + 6HCl → 2AlCl3 + 3H2
Phản ứng của kim loại với dung dịch muối: Zn + CuSO4 → ZnSO4 + Cu
Lời giải:
Oxit axit là: SO3, SO2, N2O3
Oxit bazơ là: CuO, CaO, Fe2O3
SO3: Lưu huỳnh trioxit
SO2: Lưu huỳnh đioxit
N2O3: Đinitơ trioxit
CaO: Canxi oxit
Fe2O3: Sắt(III) oxit
CuO: Đồng(II) oxit
A. Ba, Mg;
B. Fe, Al;
C. Al, Ag;
D. Cả 5 kim loại.
Lời giải
Đáp án đúng là: D
Trích mẩu thử.
Cho dung dịch H2SO4 loãng lần lượt vào các mẩu thử.
- Kim loại không phản ứng là Ag.
- Kim loại phản ứng có khí thoát ra và thu được kết tủa trắng là Ba.
Ba + H2SO4 → BaSO4↓ + H2↑
- Các trường hợp còn lại (Mg, Fe, Al – gọi chung nhóm I) chỉ thấy hiện tượng có khí thoát ra.
Mg + H2SO4 → MgSO4 + H2↑
Fe + H2SO4 → FeSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
- Cho 1 ít kim loại Ba vừa nhận ra ở trên tác dụng với nước, thu dung dịch Ba(OH)2. Sau đó lấy dung dịch thu được tác dụng với dung dịch muối sunfat của các kim loại nhóm I.
+ Dung dịch tạo kết tủa trắng xanh rồi hóa nâu là FeSO4 → kim loại ban đầu là Fe.
FeSO4 + Ba(OH)2 → BaSO4↓ + Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
+ Dung dịch tạo kết tủa keo trắng rồi tan dần một phần là Al2(SO4)3 → kim loại ban đầu là Al.
Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4↓ + 2Al(OH)3↓
2Al(OH)3 + Ba(OH)2 →
+ Dung dịch tạo kết tủa trắng là MgSO4 → kim loại ban đầu là Mg.
MgSO4 + Ba(OH)2 → BaSO4↓ + Mg(OH)2↓
a) Viết phương trình phân tử và ion rút gọn của các phản ứng.
b) Tính nồng độ mol của dung dịch Al2(SO4)3 và tính V.
Lời giải
Phản ứng xảy ra:
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3↓ + 3(NH4)2SO4
Hoà tan lượng kết tủa trên:
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Ta có: nNaOH = 0,5. 3 = 1,5 (mol) =
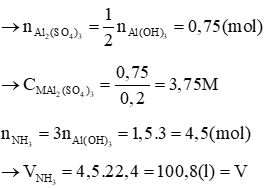
Lời giải
Theo bài ra ta có: p + e + n = 95 (1)
Và n = 0,5833(p + e) (2)
Mà p = e (3)
Từ (1); (2); (3) có: p = e = 30; n = 35.
Vì p = e = Z → Z = 30 (Z là số nguyên tử)
Vì kẽm có Z = 30 nên đây là nguyên tử Zn.
Số khối của R là 30 + 35 = 65.