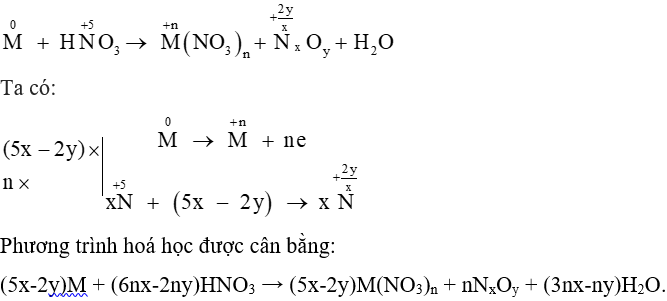Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học (Phần 2)
A. 40,8 ;
B. 38,0;
C. 32,4;
D. 35,2.
Lời giải:
Đáp án đúng là: D
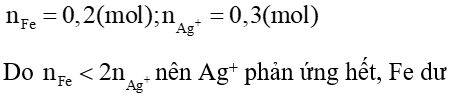
nFe phản ứng =
Chất rắn A gồm Fe dư 0,05 mol; 0,3 mol Ag
mrắn = 0,05. 56 + 0,3. 108 = 35,2 gam
A. 25,45 lít;
B. 127,23 lít;
C. 138,52 lít;
D. 95,62 lít.
Lời giải:
Đáp án đúng là: B
Trong 10 gam khí đó có:
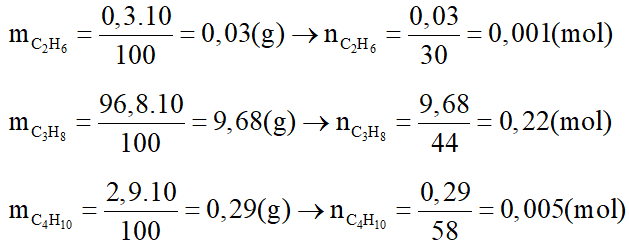
Phương trình hoá học:
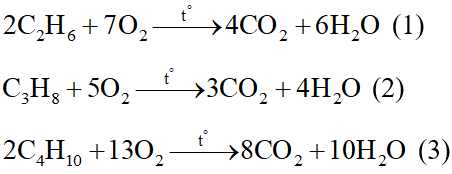
Theo PTHH (1), (2), (3):
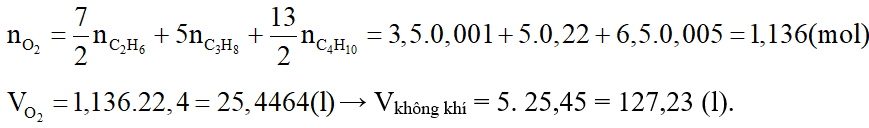
Lời giải:

2NaOH + SO2 → Na2SO3 + H2O
0,3………0,15…….0,15 (mol)
→nNaOH dư = 0,75 – 0,3 = 0,45 (mol)
Sau phản ứng dung dịch gồm 0,45 mol NaOH dư và 0,15 mol Na2SO3
Nồng độ % các chất sau phản ứng là:
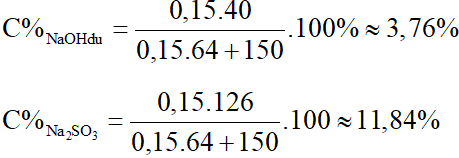
Câu 4: Dẫn 8,96 lít khí SO2 vào 200 gam dung dịch NaOH 18%. Tính nồng độ % các chất sau phản ứng.
Lời giải:

2NaOH + SO2 → Na2SO3 + H2O
0,8………0,4…….0,4 (mol)
→nNaOH dư = 0,9 – 0,8 = 0,1 (mol)
Sau phản ứng dung dịch gồm 0,1 mol NaOH và 0,4 mol Na2SO3
Nồng độ % các chất sau phản ứng là:
![]()
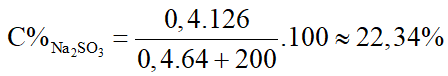
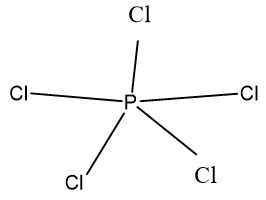
Câu 5: Viết công thức cấu tạo của phân tử PCl5?
Lời giải:
Câu 6: Oxit cao nhất của một nguyên tố A chứa 52,94% khối lượng A. Xác định A.
A. Mg;
B. Al;
C. Ba;
D. S.
Lời giải:
Đáp án đúng là: B
Đặt công thức của oxit cao nhất là A2On
→MA = 9n
Với n = 3 thì MA = 27 g/ mol (thoả mãn).
Vậy A là nhôm (Al).
Câu 7: Biết rằng 2,3 gam một kim loại R (có hóa trị I) tác dụng vừa đủ với 1,12 lít khí clo (ở đktc) theo sơ đồ phản ứng
a, Xác định tên kim loại R.
b, Tính khối lượng hợp chất tạo thành.
Lời giải:
a.
Phương trình hoá học:
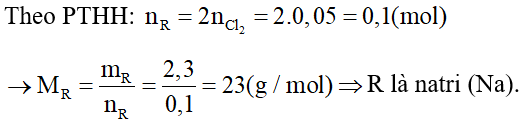
b. Phương trình hoá học:
→ mNaCl = 0,1. 58,5 = 5,85 (g)
Vậy khối lượng hợp chất tạo thành là 5,85 gam.
Lời giải:
- Trích mẫu thử: Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít ra ống nghiệm đánh số tương ứng.
- Lấy dung dịch Na2CO3 cho vào mỗi ống trên:
+ Xuất hiện kết tủa trắng → Nhận biết được BaCl2
Phương trình hoá học: BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
+ Có khí bay lên → Nhận biết được HCl:
Phương trình hoá học: 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
+ Hai ống nghiệm không có hiện tượng gì chứa NaCl và Na2SO4
- Dùng BaCl2 vừa nhận biết được ở trên cho vào hai mẫu NaCl và Na2SO4:
+ Xuất hiện kết tủa trắng → Nhận biết được Na2SO4
Phương trình hoá học: Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
+ Còn lại không hiện tượng là NaCl.
Câu 9: Tính thể tích của hỗn hợp (ở đktc) gồm 14 gam nitơ và 4 gam khí NO.
Lời giải:
Thể tích hỗn hợp khí ở đktc là:
Câu 10: Trong cấu hình electron của 11Na có bao nhiêu phân lớp?
Lời giải:
Cấu hình electron của 11Na là: 1s22s22p63s1.
⇒ Trong cấu hình electron của Na có 4 phân lớp: 1s, 2s, 2p, 3s.
Sắp xếp các phân lớp theo thứ tự phân mức năng lượng tăng dần là:
1s < 2s < 2p < 3s.
Câu 11: Hòa tan 2 gam NaOH với nước thu được 500 ml dung dịch X. Tính pH của dung dịch X.
Lời giải:
V = 0,5 lít
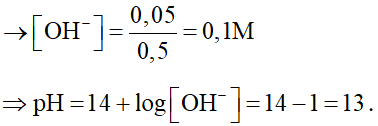
Vậy pH = 13.
Lời giải:
Trong hỗn hợp ban đầu chỉ có 1 ankan, 1 anken và hiđro nên khi A qua xúc tác Ni nung nóng, ankan không tham gia phản ứng cộng, chỉ có phản ứng cộng giữa anken và hiđro để tạo thành ankan:
Do phản ứng trên xảy ra hoàn toàn nên sẽ có 1 trong 2 khí là anken và hiđro phản ứng hết. Vậy sau phản ứng hỗn hợp khí B có thể có trường hợp sau:
(1) 2 ankan và 1 anken còn dư (hiđro hết)
(2) 2 ankan và hiđro dư (anken hết)
Cho B qua bình đựng dung dịch brom dư thấy dung dịch brom bị nhạt màu một phần nên đã có phản ứng cộng Br2, như thế hỗn hợp B chỉ có thể là trường hợp 1.
Khối lượng bình Br2 tăng 0,28 gam chính là khối lượng của anken còn dư, khí còn lại có thể tích 560 cm3 và có tỉ khối hơi so với hiđro là 9,4 chính là 1 hỗn hợp gồm 2 ankan.

Hỗn hợp A (ankan, anken, hiđro) qua Ni nung nóng thu được B (ankan cũ, ankan mới, anken dư)→ nanken phản ứng = nhiđro = nA - nB = 0,04 – 0,035 = 0,005 (mol)
→ Ankan mới tạo thành là C2H6 có số mol là 0,005 mol
→ nankan cần tìm = n2 ankan – = 0,025 – 0,005 = 0,02 (mol)
Hỗn hợp B gồm 0,005 mol C2H6 và 0,01 mol CnH2n+2
mB = 0,005. 30 + 0,02. (14n + 2) = 9,4. 2. 0,025 → n = 1
Vậy ankan cần tìm là CH4
Vậy công thức phân tử của 2 hiđrocacbon cần tìm là CH4 và C2H4.
Câu 13: Dung dịch muối nào sau đây có màu xanh lam?
A. FeCl2;
B. MgCl2;
C. Fe2(SO4)3;
D. CuCl2.
Lời giải:
Đáp án đúng là: D
Dung dịch muối có màu xanh lam là CuCl2.
a) Tính phần trăm khối lượng mỗi kim loại hỗn hợp đầu.
b) Tính thể tích dung dịch HCl cần dùng vừa đủ.
Lời giải:
a) Gọi nAl = x (mol; x > 0); nFe = y (mol; y > 0)
Mà mAl + mFe = 11 → 27x + 56y = 11 (1)
Phương trình hoá học xảy ra như sau:
2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
Theo các PTHH trên:
(2)
Giải (1), (2), ta được: x = 0,2 (mol); y = 0,1 (mol)
%mFe = 100% – 49,09% = 50,91%
![]()
Lời giải:
Theo đề bài:![]()
Gọi nCuO phản ứng là x (mol; x > 0)
Phương trình hoá học:
Theo PTHH: nCu = nCuO phản ứng = x (mol)
nCuO dư = 0,02 – x (mol)
Chất rắn thu được sau phản ứng gồm Cu và CuO dư
→ 64. x + (0,02 – x). 80 = 1,344 → x = 0,016
Vậy hiệu suất phản ứng là 80%
A. 66,67%;
B. 33,33%;
C. 55,28%;
D. 45,72%.
Lời giải:
Đáp án đúng là: B
PTHH:
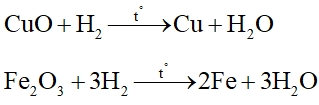
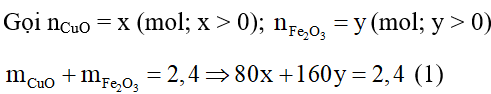
Phản ứng xảy ra hoàn toàn:
mchất rắn = mCu + mFe = 1,76 → 64x + 56. 2y = 1,76 (2)
Giải (1), (2), ta được: x = y = 0,1
.
Câu 17: Khi nào Fe hoá trị II và khi nào hoá trị III?
Lời giải:
1) Fe hóa trị II
Sắt thể hiện hóa trị II khi cho Fe tác dụng với các axit trung bình, axit mà gốc axit không có tính oxi hoá như H2SO4 loãng, HCl…
Ngoài ra, khi cho Fe tác dụng với dung dịch muối của kim loại yếu hơn như muối đồng, muối chì … hoặc muối sắt (III) hay khi cho Fe tác dụng với phi kim hoạt động trung bình hoặc yếu … thì tạo muối Fe(II).
Ví dụ:
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 loãng → FeSO4 + H2
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe + 2FeCl3 → 3FeCl2
Fe + S FeS.
2) Fe hóa trị III
Sắt thể hiện hóa trị III khi cho Fe tác dụng với các axit có tính oxi hoá mạnh như H2SO4 đặc, nóng; HNO3 …. Hay khi cho Fe tác dụng với một số phi kim mạnh như Cl2, F2 …
Ví dụ:
2Fe + 6H2SO4 (đặc, nóng) → Fe2(SO4)3 + 6H2O + 3SO2
Ngoài ra, hợp chất sắt(II) khi tác dụng với chất oxi hoá mạnh cũng bị oxi hoá lên hợp chất sắt(III). Ví dụ:
Câu 18: FeCl3 + NaOH ----> Fe(OH)3 + NaCl
- Trình bày cân bằng phản ứng hoá học.
Lời giải:
Phương trình hoá học cân bằng là:
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Lời giải:
Cấu hình electron nguyên tử X là: 1s22s22p63s23p63d104s24p4
→ Z = 34 → X là Se thuộc chu kì 4, nhóm VIA trong bảng tuần hoàn.
Cấu hình electron nguyên tử Y là: 1s22s22p63s23p63d104s24p64d15s2
→ Z = 39 → Y là Y thuộc chu kì 5, nhóm IIIB trong bảng tuần hoàn
Phương trình hoá học giải thích sự hình thành liên kết giữa X và Y là:
X2- + Y3+ → X3Y2.
Câu 20: Trộn lẫn 500 ml dung dịch NaOH 0,1M với 400 ml dung dịch H2SO4 0,1M, thu được dung dịch Y. Cô cạn dung dịch Y thu được bao nhiêu gam muối khan?
A. 5,68 gam;
B. 3,55 gam;
C. 5,02 gam;
D. 2,84 gam.
Lời giải:
Đáp án đúng là: B
Phương trình hoá học:
2NaOH + H2SO4 Na2SO4 + 2H2O
Lập tỉ lệ: H2SO4 dư
Theo PTHH: ![]()
= 0,04 – 0,025 = 0,015 (mol)
Dung dịch sau phản ứng gồm 0,015 mol H2SO4 dư, Na2SO4 0,025 mol
Cô cạn dung dịch Y thu được số gam muối khan là: 0,025. 142 = 3,55 (g).
Lời giải:
Áp dụng bảo toàn điện tích trong dung dịch Y, ta có:
0,1. 2 + 0,3. 2 = 0,4. 1 + y. 1 → y = 0,4
Khi cô cạn dung dịch Y, xảy ra phản ứng sau:

Khối lượng muối khan thu được là:
![]()
= 0,1. 40 + 0,3. 24 + 0,4. 35,5 + 0,2. 60 = 37,4 (g).
A. 1,28;
B. 0,28 ;
C. 12,8 ;
D. 128.
Lời giải:
Đáp án đúng là: A
Thể tích của 1 mol Fe là:
Thể tích của một nguyên tử Fe là:
Bán kính gần đúng của nguyên tử Fe là:
A. 7,8 gam;
B. 10,4 gam;
C. 8,0 gam;
D. 12,0 gam.
Lời giải
Đáp án đúng là: C
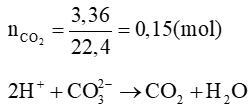
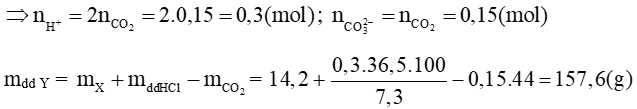

Với n = 2 thì MM = 56 (g/mol). Vậy M là sắt (Fe)
Bảo toàn nguyên tố Fe, ta có:
→ Chất rắn gồm MgO: 0,1 mol; Fe2O3 0,025 mol
mchất rắn = 0,1. 40 + 0,025. 160 = 8 (g)
Câu 24: Cặp chất nào sau đây có cùng phân tử khối:
A. N2 và CO2;
B. SO2 và C4H10;
C. NO và C2H6;
D. CO và N2O.
Lời giải:
Đáp án đúng là: C
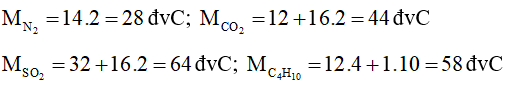
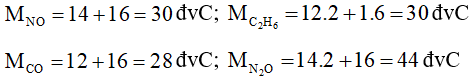
Cặp chất có cùng phân tử khối là NO và C2H6.
Câu 25: H2 khác 2H như thế nào?
Lời giải:
H2 chỉ một phân tử hiđro
2H chỉ hai nguyên tử hiđro.
Câu 26: Brom có 2 đồng vị ![]() , biết . Nếu có 89 nguyên tử
, biết . Nếu có 89 nguyên tử ![]() thì có bao nhiêu nguyên tử
thì có bao nhiêu nguyên tử ![]() ?
?
Lời giải:
Gọi phần trăm của mỗi đồng vị brom lần lượt là x và y (%)
→ x + y = 100 (1)
Nguyên tử khối trung bình của brom là 79,82
(2)
Giải hệ (1), (2), ta được: x = 59, y = 41
![]() chiếm 59% có 89 nguyên tử
chiếm 59% có 89 nguyên tử
![]() chiếm 41% có nguyên tử
chiếm 41% có nguyên tử
Vậy nếu có 89 nguyên tử ![]() thì có 62 nguyên tử
thì có 62 nguyên tử ![]() .
.
A. HCOOC2H5;
B. CH3COOCH3;
C. HCOOCH3
D. CH3COOC2H5.
Lời giải:
Đáp án đúng là: C
Vì → E là este no, đơn chức có công thức phân tử là: CnH2nO2
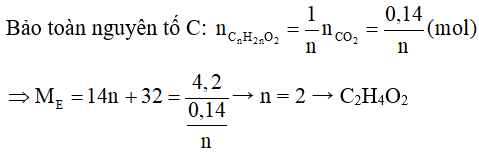
Công thức cấu tạo của E là HCOOCH3.
Lời giải:
Trong 1 tấn gang chứa 95% Fe có
Phương trình phản ứng:
Ta có: 160 kg Fe2O3 tạo ra 2. 56 = 112 kg Fe
x kg Fe2O3 tạo ra 950 kg Fe
Hiệu suất đạt 80% nên thực tế Fe2O3 cần dùng:
![]()
Khối lượng quặng hematit chứa 60% Fe2O3 cần dùng:
mquặng =
Câu 29: a) Tính hóa trị của Mg trong hợp chất MgCO3 (biết CO3 có hóa trị II).
b) Lập công thức hoá học của hợp chất tạo bởi Fe (III) và SO4 (II).
c) Nêu ý nghĩa của công thức hoá học MgCO3.
Lời giải:
a) Gọi hóa trị của Mg trong hợp chất MgCO3 là a
Theo quy tắc hoá trị, ta có: a. 1 = II. 1 → a = II
Vậy hóa trị của Mg trong hợp chất MgCO3 là II.
b) Gọi công thức hoá học của hợp chất tạo bởi Fe (III) và SO4 (II) là Fex(SO4)y
Theo quy tắc hoá trị, ta có: III. x = II. y
→ x = 2, y = 3
Vậy công thức hoá học của hợp chất tạo bởi Fe (III) và SO4 (II) là Fe2(SO4)3
c) Ý nghĩa của công thức hoá học MgCO3:
- Hợp chất gồm 3 nguyên tố magie (Mg), cacbon (C) và oxi (O) tạo thành.
- Trong 1 phân tử chất, có 1 nguyên tử Mg, 1 nguyên tử C, 3 nguyên tử O
- PTK MgCO3 = 24 + 12 + 16. 3 = 84 đvC.
Lời giải:
Trường hợp 1:
Gọi kim loại M có hoá trị n ( ) nên oxit của kim loại M sẽ là M2On
Phương trình phản ứng:
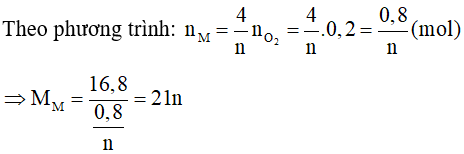
Ta có:
|
n |
1 |
2 |
3
|
|
MM |
21 (loại) |
42 (loại) |
63 (loại) |
Vậy không có kim loại M nào thoả mãn.
Trường hợp 2: Kim loại là Fe
3Fe + 2O2 Fe3O4.
0,3 ⟵ 0,2 mol
Vậy mFe = 0,3.56 = 16,8 trùng khối lượng đề bài cho.
Vậy kim loại M là Fe.
Lời giải:
Bảo toàn khối lượng có:
Trường hợp 1:
Gọi kim loại M có hoá trị n ( ) nên oxit của kim loại M sẽ là M2On
Phương trình phản ứng:
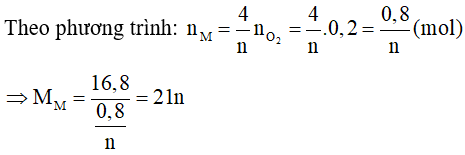
Ta có:
|
n |
1 |
2 |
3
|
|
MM |
21 (loại) |
42 (loại) |
63 (loại) |
Vậy không có kim loại M nào thoả mãn.
Trường hợp 2: Kim loại là Fe
Bảo toàn khối lượng có:
3Fe + 2O2 Fe3O4.
0,3 ⟵ 0,2 mol
Vậy mFe = 0,3.56 = 16,8 trùng khối lượng đề bài cho.
Vậy kim loại M là Fe.
A. (3a + 2b) mol;
B. (3,2a + 1,6b) mol;
C. (1,2a + 3b) mol;
D. (4a + 3,2b) mol.
Lời giải:
Đáp án đúng là: D
P + 5HNO3 → H3PO4 + 5NO2↑ + H2O
a….5a…………a (mol)
S + 6HNO3 → H2SO4 + 6NO2↑ + 2H2O
b…..6b……….b (mol)
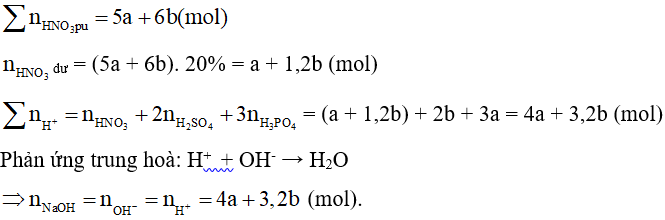
Câu 33: Tính hoá trị của C trong CO2 biết oxi hoá trị là II?
Lời giải:
Gọi hoá trị của C trong CO2 là a
Theo quy tắc hoá trị, ta có: a. 1 = II. 2 → a = IV
Vậy hóa trị của C trong hợp chất CO2 là IV.
A. 0,4 mol;
B. 0,8 mol;
C. 0,2 mol;
D. 0,6 mol.
Lời giải:
Đáp án đúng là: B
Phương trình phản ứng: P2O5 + 4NaOH → 2Na2HPO4 + H2O
Theo phương trình:
Câu 35: Viết 8 phản ứng khác nhau điều chế CO2?
Lời giải:
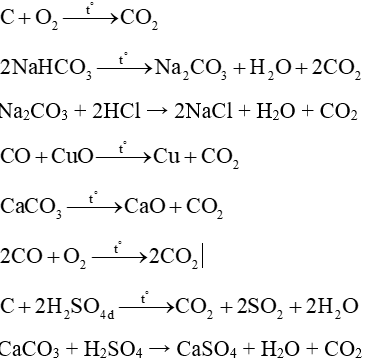
Câu 36: Cân bằng phương trình hoá học sau theo phương pháp thăng bằng electron.
Lời giải:
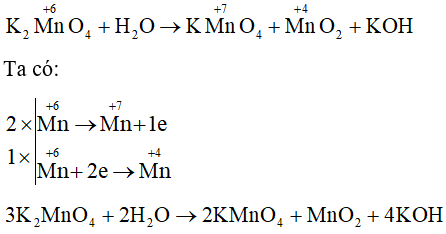
Câu 37: Khi delta H (lượng nhiệt phản ứng) < 0 thì phản ứng đó toả nhiệt hay thu nhiệt?
Lời giải:
Khi delta H (Lượng nhiệt phản ứng) < 0 thì phản ứng đó toả nhiệt.
Câu 38: Công thức cấu tạo của phân tử HCl là:
A. H – Cl;
B. H → Cl;
C. H = Cl;
D. Cl → H.
Lời giải:
Đáp án đúng là: A
Công thức cấu tạo của phân tử HCl là H – Cl.
A. 0,54 gam;
B. 0,74 gam;
C. 0,94 gam;
D. 0,47 gam.
Lời giải:
Đáp án đúng là: C
Khối lượng giảm là tổng khối lượng của NO2 và O2:
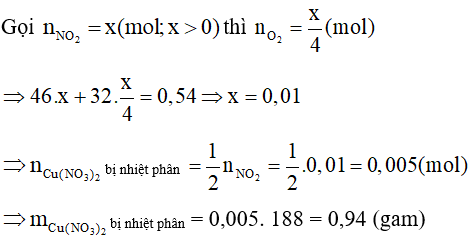
Câu 40: Nhóm HPO4 có hoá trị là mấy?
Lời giải:
Nhóm photphat (PO4) có hoá trị là III
Nhóm HPO4 có thêm 1 nguyên tử H nên hoá trị của (HPO4) là: 3 – 1 = 2
Vậy nhóm HPO4 có hoá trị là II.
a) Tính % khối lượng mỗi kim loại trong hỗn hợp X ban đầu.
b) Tính thể tích dung dịch HCl 20% (d = 1,1 g/ml) đã dùng, biết người ta đã dùng dư 10% so với lượng cần thiết.
Lời giải:
a)
Phương trình hoá học:
2Al + 6HCl → 2AlCl3 + 3H2
mAl = 0,1. 27 = 2,7 (g)
→ %mCu = 100% – 45,76% = 54,24%
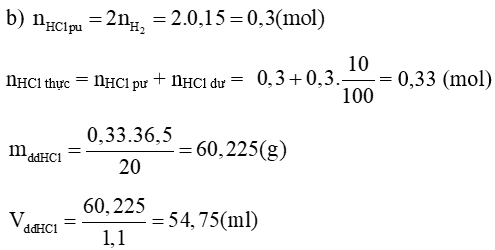
a) Tính khối lượng dung dịch HCl tham gia phản ứng.
b) Tính nồng độ phần trăm các chất trong dung dịch ban đầu.
c) Từ dung dịch ban đầu muốn thu được dung dịch mới có nồng độ phần trăm mỗi muối đều là 8,69% thì phải hòa tan bao nhiêu gam mỗi muối nói trên.
Lời giải:
a) Na2CO3 + HCl → NaCl + NaHCO3 (1)
K2CO3 + HCl → KCl + KHCO3 (2)
NaHCO3 + HCl → NaCl + CO2 + H2O (3)
KHCO3 + HCl → KCl + CO2 + H2O (4)
Ca(OH)2 + NaHCO3 → NaOH + CaCO3 + H2O (5)
Ca(OH)2 + KHCO3 → KOH + CaCO3 + H2O (6)
Ta có:
Theo PTHH (1) và (6), ta có:
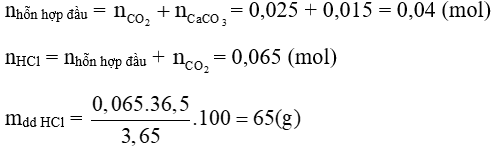
b) Gọi số mol của Na2CO3 và K2CO3 lần lượt là x mol và y mol
Ta có hệ phương trình:
mhỗn hợp ban đầu = 4,56 + 45,44 = 50 (g)
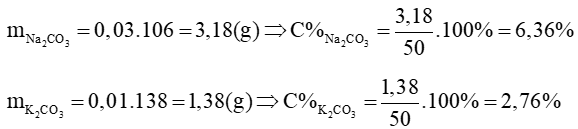
c) Gọi số mol của Na2CO3 và K2CO3 cần thêm vào lần lượt là a mol và b mol
Vì C% bằng nhau nên ta có: 3,18 + 106a = 1,38 + 138b (*)
Theo C% ta có:
Từ (*) và (**) giải ra được: a = 0,015; b = 0,0246
Vậy khối lượng mỗi muối cần thêm vào là:
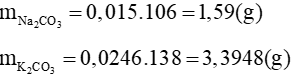
Câu 43: Thể tích dung dịch NaOH 2M tối thiểu để hấp thụ hết 4,48 lít khí CO2 (đktc) là:
A. 200 ml;
B. 100 ml;
C. 150 ml;
D. 250 ml.
Lời giải:
Đáp án đúng là: B
Vì dùng dung dịch NaOH tối thiểu để hấp thụ CO2 nên:
Phương trình phản ứng: NaOH + CO2 → NaHCO3
Vdd NaOH =
Câu 44: Hiện tượng xảy ra khi cho 1 lá nhôm vào dung dịch H2SO4 đặc, nguội?
A. Khí mùi hắc thoát ra
B. Khí không màu và không mùi thoát ra
C. Lá nhôm tan dần
D. Không có hiện tượng
Lời giải:
Đáp án đúng là: D
Chú ý: Một số kim loại như Al, Fe, Cr … không tác dụng với H2SO4 đặc, nguội
Lời giải:
Ở 12oC: S = 33,5 gam
Cứ 100 gam nước hoà tan 33,5 gam CuSO4 tạo thành 133,5 gam dung dịch bão hoà
Cứ x gam nước hoà tan y gam CuSO4 tạo thành 1335 gam dung dịch bão hoà
→ x = 1000 gam nước; y = 335 gam CuSO4
Gọi a là số gam CuSO4 (a > 0) cần thêm để được dung dịch bão hoà ở 90oC
Ta có: = 1000 (g)
= (335 + a) (g)
Theo bài ra, ta có:
Vậy khối lượng CuSO4 cần thêm là 465 gam.
Câu 46: Cho các nhận định sau về protein, nhận định nào đúng?
A. Protein được cấu tạo từ các loại nguyên tố hóa học: C, H, O;
B. Protein mất chức năng sinh học khi cấu trúc không gian bị phá vỡ;
C. Protein ở người và động vật được tổng hợp bới 20 loại axit amin lấy từ thức ăn;
D. Protein đơn giản gồm nhiều chuỗi pôlipeptit với hàng trăm axit amin.
Lời giải:
Đáp án đúng là: B
Protein chỉ thực hiện được chức năng ở cấu trúc không gian (cấu trúc bậc 3 hoặc bậc 4).
Khi cấu trúc không gian 3 chiều (protein ở dạng bậc 3 hoặc bậc 4) bị phá vỡ (do nhiệt độ, pH….) thì làm cho chúng mất đi chức năng sinh học.
Câu 47: Tính tổng số mol có trong hỗn hợp khí sau: 0,44 gam CO2; 0,04 gam H2; 0,56 gam N2.
Lời giải:
Tổng số mol của các khí trong hỗn hợp:
Câu 48: Dẫn ra các phương trình hóa học chứng minh nitơ có tính oxi hóa và có tính khử.
Lời giải:
Các phương trình hóa học chứng minh nitơ có tính oxi hóa và có tính khử.
- Nitơ có tính oxi hoá:
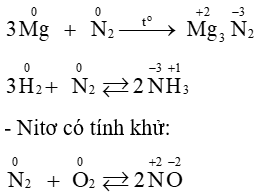
A. CaCO3;
B. Zn;
C. Cu;
D. Na2O.
Lời giải:
Đáp án đúng là: B
Zn + 2HCl → ZnCl2 + H2 ↑
Khí H2 nhẹ hơn không khí, cháy trong không khí với ngọn lửa màu xanh nhạt.
Câu 50: Xác định hoá trị của Fe trong Fe3O4?
Lời giải:
Fe3O4 được coi như là hỗn hợp của FeO và Fe2O3 theo tỉ lệ 1:1. Cho nên hoá trị của Fe trong hợp chất đó là có cả II và III.
Hoá trị trung bình của Fe trong hợp chất trên là
Câu 51: Cân bằng phương trình hoá học: Fe + HCl + Fe3O4 → FeCl2 + H2O
Lời giải:
Fe + 8HCl + Fe3O4 → 4FeCl2 + 4H2O
a) dd (2) tạo kết tủa trắng với dd (1), (3), (4).
b) dd (5) tạo kết tủa trắng với dd (1), (3), (4).
c) dd (2) không tạo kết tủa với dd (5).
d) dd (1) không tạo kết tủa với dd (3), (4).
e) dd (6) không phản ứng với dd (5).
f) dd (5) được trung hòa bởi HCl.
g) dd (3) tạo kết tủa với HCl và tan khi bị đun nóng.
Lời giải:
f, dd (5) được trung hoà bởi HCl nên (5) là NaOH.
g, dd (3) tạo kết tủa với HCl, tan kết tủa khi đun nóng nên (3) là Pb(NO3)2.
d, dd (1) không tạo kết tủa với Pb(NO3)2 nên (1) là Ba(NO3)2.
Ba(NO3)2 không tạo kết tủa với (4) nên (4) là CaCl2.
a, dd (2) kết tủa trắng với Ba(NO3)2, Pb(NO3)2, CaCl2 nên (2) là (NH4)2SO4.
→ Còn lại (6) là Na2CO3.
Câu 53: Nhận biết các dung dịch bằng phương pháp hoá học: NaOH, Ca(NO3)2, H2SO4, K2SO4.
Lời giải:
- Cho các chất tác dụng với quỳ tím:
+ Chất nào làm quỳ tím hoá đỏ là H2SO4.
+ Chất nào làm quỳ tím hoá xanh là NaOH.
+ Không làm quỳ tím đổi màu là: Ca(NO3)2 và K2SO4 (nhóm I).
- Cho 2 chất nhóm I tác dụng với BaCl2:
Xuất hiện kết tủa là K2SO4; còn lại không hiện tượng là Ca(NO3)2.
Phương trình: K2SO4 + BaCl2 → 2KCl + BaSO4↓.
Câu 54: Nhận biết các dung dịch bằng phương pháp hoá học: HNO3, Ca(OH)2, H2SO4, KCl.
Lời giải:
Cho quỳ tím vào từng mẫu thử
+ Quỳ hóa xanh: Ca(OH)2
+ Quỳ hóa đỏ: H2SO4, HNO3 (nhóm I)
+ Quỳ không đổi màu: KCl
Cho dung dịch BaCl2 vào 2 mẫu làm quỳ hóa đỏ (nhóm I)
+ Kết tủa: H2SO4
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
+ Không hiện tượng: HCl.
Lời giải:
Đề bài yêu cầu tính thể tích dung dịch NaOH tối thiểu để không còn kết tủa nên xảy ra 2 phản ứng hoá học sau:
Zn(NO3)2 + 2NaOH → Zn(OH)2↓ + 2NaNO3
2NaOH + Zn(OH)2 → Na2ZnO2 + 2H2O
Theo phương trình trên:
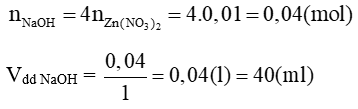
A. 5nx - 2ny.
B. 5nx - 2y.
C. 6nx - 2y.
D. 6nx - 2ny.
Lời giải:
Đáp án đúng là: D