Tailieumoi.vn biên soạn và giới thiệu bộ câu hỏi Hóa học gồm các kiến thức lý thuyết và thực hành, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
Top 1000 câu hỏi thường gặp môn Hóa học (Phần 1)
Bài 1: K2SO4 có tác dụng với NaOH không?
Lời giải:
K2SO4 không tác dụng với NaOH, do không thoả mãn điều kiện xảy ra phản ứng trao đổi.
A. 40%.
B. 50%.
C. 60%.
D. 20%.
Lời giải:
Đáp án đúng là: B
Phương trình hoá học:
3H2 + N2 2NH3
Ban đầu: 12 5 0 mol
Phản ứng: 3x x 2x mol
Cân bằng: (12 – 3x) (5 – x) 2x mol
Tại thời điểm cân bằng thu được 13 mol khí.
⇒ (12 – 3x) + (5 – x) + 2x = 13 ⇒ x = 2 (mol).
Giả sử H = 100% thì H2 hết, do đó hiệu suất phản ứng tính theo H2.
Vậy H =
Lời giải:
nNaOH = 0,25. 4 = 1 (mol)
Phương trình hoá học:
6NaOH + Al2(SO4)3 → 3Na2SO4 + 2Al(OH)3↓ (1)
Lập tỉ lệ: → NaOH dư
Theo phương trình hoá học (1):
-
- nNaOH (phản ứng) =
→nNaOH (dư) = 1 – 0,6 = 0,4 (mol)
Phương trình hoá học:
NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
→ Kết tủa Al(OH)3 tan hoàn toàn, dung dịch sau phản ứng gồm các chất tan NaOH dư, Na2SO4 và NaAlO2.
Vậy khối lượng kết tủa sau phản ứng bằng 0.
Bài 4: Cân bằng phương trình hoá học sau:
CnH2n-2 + O2 CO2 + H2O
Lời giải:
Bước 1: Cân bằng C
Vế trái có n nguyên tử C, vế phải có 1 nguyên tử C nên thêm n vào CO2 và 1 vào CnH2n-2 (thường số 1 ta sẽ không ghi để cho đỡ phức tạp).
CnH2n-2 + O2 nCO2 + H2O
Bước 2: Cân bằng H
Vế trái có (2n – 2) nguyên tử H, vế phải có 2 nguyên tử H nên thêm (n – 1) vào H2O
CnH2n-2 + O2 nCO2 + (n – 1)H2O
Bước 3: Tổng số O bên vế phải là 2.n trong CO2 và (n – 1) trong H2O, tức bằng
(2.n + n – 1) = (3n – 1) nguyên tử O. Vế trái có 2 nguyên tử O, thêm vào O2
.
Bài 5: Oxit của một nguyên tố hoá trị (II) chứa 28,57% oxi về khối lượng. Nguyên tố đó là
A. Ca;
B. Mg;
C. Fe;
D. Cu.
Lời giải:
Đáp án đúng là: A
Gọi A là nguyên tố cần tìm, đồng thời A là khối lượng mol của nguyên tố đó
Vì A có hoá trị II nên công thức oxit của A với oxi sẽ là AO
Theo đề ra, ta có:
Vậy nguyên tố cần tìm là canxi (Ca).
Lời giải:
0,1.………0,2…..0,1 (mol)
HCl → H+ + Cl-
0,2…..0,2….0,2 (mol)
NaOH → Na+ + OH-
0,3……...0,3…..0,3 (mol)
Ca(OH)2 → Ca2+ + 2OH-
0,05………0,05…..0,1 (mol)
Khi đổ hỗn hợp axit và hỗn hợp kiềm thì xảy ra phản ứng sau:
H+ + OH- → H2O
0,4…0,4 (mol)
Vậy dung dịch sau phản ứng có 0,1 mol , 0,2 mol Cl-, 0,3 mol Na+, 0,05 mol Ca2+. Khối lượng muối tạo thành là:
mmuối = 0,1. 96 + 0,2. 35,5 + 0,3. 23 + 0,05. 40 = 25,6 (g).
Lời giải:
Khi trộn Na3PO4 vào dung dịch HCl thì sẽ có những phản ứng là:
Na3PO4 + HCl → Na2HPO4 + NaCl
Na3PO4 + 2HCl → NaH2PO4 + 2NaCl
Na3PO4 + 3HCl → H3PO4 + 3NaCl.
Bài 8: Cho 34,8g hỗn hợp kim loại gồm Al, Fe, Cu thành hai phần bằng nhau.
- Phần 1: Cho vào dung dịch HNO3 đặc nguội thu được 4,48 lít khí NO2 ở đktc.
- Phần 2: Cho vào dung dịch HCl dư thu được 8,96 lít khí H2 (đktc).
Xác định khối lượng Al, Fe trong hỗn hợp ban đầu.
Lời giải:
Chia hỗn hợp làm 2 phần bằng nhau nên khối lượng hỗn hợp kim loại ở mỗi phần là
Phần 1: Ta có: Fe và Al thụ động với HNO3 đặc, nguội nên chỉ có Cu phản ứng theo phương trình hoá học: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (1)
Theo đề bài ra:
Theo PTHH (1):
→mCu = 0,1. 64 = 6,4 (g)
Phần 2: Cho hỗn hợp kim loại vào dung dịch HCl, Cu không phản ứng, Fe, Al phản ứng theo các PTHH sau:
Fe + 2HCl→ FeCl2 + H2 (2)
2Al + 6HCl → 2AlCl3 + 3H2 (3)
Gọi số mol của Fe, Al trong mỗi phần lần lượt là x, y (mol; x,y > 0)
Vì mCu = 6,4 (g) → mFe + mAl = 17,4 – 6,4 = 11 → 56. x + 27. y = 11 (*)
Theo PTHH (2)
Theo PTHH (3):
Mà → (**)
Giải hệ (*), (**), ta được: x = 0,1; y = 0,2
Vậy khối lượng Al, Fe trong hỗn hợp đầu là:
mAl = 0,2. 27. 2 = 10,8 (g); mFe = 0,1. 56. 2 = 11,2 (g)
A. 0,03 mol Ca(NO3)2 và 0,06 mol Al2(SO4)3;
B. 0,03 mol CaSO4 và 0,06 mol Al(NO3)3;
C. 0,09 mol CaSO4 và 0,06 mol Al(NO3)3;
D. 0,03 mol Ca(NO3)2 và 0,03 mol Al2(SO4)3.
Lời giải:
Đáp án đúng là: D
Ca2+ + 2 → Ca(NO3)2
0,03….0,06…….0,03 (mol)
2Al3+ + 3 → Al2(SO4)3
0,06……0,09…….0,03 (mol)
Vậy muốn có dung dịch A cần phải hòa tan hai muối: 0,03 mol Ca(NO3)2 và 0,03 mol Al2(SO4)3
A. 23,7%;
B. 76,3%;
C. 72,7%;
D. 27,3%.
Lời giải:
Đáp án đúng là: D
Ta có, gọi % số nguyên tử của đồng vị 63Cu là x (0 < x < 100%) thì % đồng vị 65Cu là 100 – x.
Nguyên tử khối trung bình của đồng là 63,546 nên:
→ x = 72,7
Vậy thành phần phần trăm theo số nguyên tử của 65Cu là 27,3%.
Bài 11: Chia hỗn hợp Cu và Al làm 2 phần bằng nhau:
- Phần 1: Tác dụng với dung dịch HNO3 đặc, nguội thì thu được 17,92 lít NO2 (đktc)
- Phần 2: Tác dụng với dung dịch HCl thì có 13,44 lít khí H2 (đktc) thoát ra.
a) Tính khối lượng mỗi kim loại trong hỗn hợp đầu.
b) Xác định phần trăm về khối lượng mỗi kim loại trong hỗn hợp?
Lời giải:
Phần 1: Hỗn hợp tác dụng với dung dịch HNO3 đặc, nguội thì Al bị thụ động (không phản ứng), Cu phản ứng theo PTHH:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (1)
Theo PTHH (1): → mCu = 0,4. 64 = 25,6 (g)
Phần 2: Cho hỗn hợp tác dụng với dung dịch HCl thì Cu không phản ứng, Al phản ứng theo PTHH:
2Al + 6HCl → 2AlCl3 + 3H2 (2)
Theo PTHH (2):
→ nAl = 0,4. 27 = 10,8 (g)
a) Khối lượng mỗi kim loại trong hỗn hợp đầu là:
mAl = 10,8. 2 = 21,6 (g)
mCu = 25,6. 2 = 51,2 (g)
b) mhỗn hợp = mAl + mCu = 21,6 + 51,2 = 72,8 (g)
Phần trăm về khối lượng mỗi kim loại trong hỗn hợp là:
.
%mCu = 100% - 29,67% = 70, 33%.
Bài 12: Tính khối lượng O2 có trong 4,48 lít khí O2 (đktc)?
A. 22,4 lít;
B. 0,2 gam;
C. 3,2 gam;
D. 6,4 gam.
Lời giải
Đáp án đúng là: D
Lời giải:
Khi hấp thụ hoàn toàn lượng khí SO2 trong 600 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được 35,5 gam chất rắn khan thì có 2 trường hợp xảy ra:
Trường hợp 1: 35,5 gam chất rắn gồm: NaHSO3 (a mol), Na2SO3 (b mol)
Ta có: (Loại)
Trường hợp 2: 35,5 gam chất rắn gồm: Na2SO3 (x mol), NaOH dư (y mol)
Ta có:
Suy ra:
Gọi kim loại trong oxit cần tìm là R, hoá trị n (), R là khối lượng mol của kim loại R.
Khi oxit kim loại hoà tan trong lượng dư dung dịch H2SO4 đặc, nóng thu được muối là R2(SO4)n
Trong oxit kim loại, gọi nR = m (mol); nO = t (mol)
→
Theo đề bài: moxit = 36 (g) → R. m + 16. t = 36 (*)
mmuối = 80 (g) → 0,5m. (2R + 96n) = 80 (**)
Mà với các quá trình chuyển e:
,
Áp dụng định luật bảo toàn e, ta có: m. n = 2. t + 0,25. 2 (***)
Giải (*), (**), (***), ta được: Rm = 32; mn = 1; t = 0,25
Với mn = 1
Mà Rm = 32
Với n = 2 thì R = 64 → R là đồng (Cu)
Vậy công thức hoá học oxit cần tìm là CuO.
(1) Trong 2 nguyên tố A, B nguyên tố nào là kim loại, nguyên tố nào là phi kim?
(2) Xác định cấu hình e của A, B và tên của A, B.
Cho biết tổng số e ở hai phân lớp ngoài cùng của A và B là 7.
b) Cho các ion A-, B2+ đều có cấu hình electron của khí trơ Ne (1s22s22p6). Viết cấu hình e của A, B và dự đoán tính chất hoá học của 2 nguyên tố này.
Lời giải:
a)
(1) Nguyên tử nguyên tố B có phân lớp e ngoài cùng là 4s nên có tối đa 2 electron ở lớp ngoài cùng nên B là nguyên tố kim loại.
Nguyên tố A không phải là khí hiếm, nguyên tử có phân lớp electron ngoài cùng là 3p, A có thể là nguyên tố kim loại hoặc phi kim.
(2) Nguyên tử nguyên tố B có phân lớp e ngoài cùng là 4s sẽ xảy ra 2 trường hợp sau:
Trường hợp 1: B có phân lớp e ngoài cùng là 4s1
→ B có cấu hình electron là 1s22s22p63s23p64s1
→ B có 19 electron → B có Z = 19
A có số electron ở phân lớp ngoài cùng là 7 – 1 = 6
→ A có phân lớp electron ngoài cùng là 3p6 → A là khí hiếm → loại
Trường hợp 2: B có phân lớp e ngoài cùng là 4s2
→ B có cấu hình electron là 1s22s22p63s23p64s2
→ B có 20 electron → B có Z = 20 → B là nguyên tố kim loại canxi (Ca).
A có số electron ở phân lớp ngoài cùng là 7 – 2 = 5
→ A có phân lớp electron ngoài cùng là 3p5
→ A có cấu hình electron là 1s22s22p63s23p5
→ A có 17 electron → A có Z = 17 → A là nguyên tố phi kim clo (Cl).
b) Ion A- có cấu hình electron của khí trơ Ne[2s22p6] nên cấu hình e của A là 1s22s22p5 → A có Z = 9, là nguyên tố phi kim. A có đầy đủ tính chất hoá học của 1 nguyên tố phi kim.
Ion B2+ có cấu hình electron của khí trơ Ne[2s22p6] nên cấu hình e của B là 1s22s22p63s2 → B có Z = 12, là nguyên tố kim loại. B có đầy đủ tính chất hoá học của 1 kim loại.
Lời giải:
Phương trình hoá học: CuO + H2SO4 → CuSO4 + H2O
Lập tỉ lệ: → H2SO4 dư, CuO phản ứng hết
→
Vậy dung dịch sau phản ứng gồm 0,2 mol H2SO4 và 0,2 mol CuSO4
Nồng độ % các chất trong dung dịch X là:
Bài 16: Viết công thức cấu tạo của N2O5?
Lời giải:
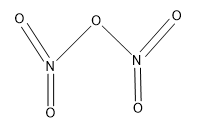
Bài 17: Trình bày phương pháp hoá học nhận biết 3 dung dịch sau: H2SO4, MgCl2, Ca(OH)2?
Lời giải:
Dùng quỳ tím để nhận biết 3 dung dịch sau: H2SO4, MgCl2, Ca(OH)2:
- Dung dịch nào làm quỳ tím chuyển màu đỏ thì là H2SO4;
- Dung dịch nào làm quỳ tím chuyển màu xanh thì là Ca(OH)2;
- Dung dịch không làm quỳ tím chuyển màu là MgCl2.
Lời giải:
nHCl (pH=1) = 1,8. 0,1 = 0,18 (mol); nHCl (pH=2) = 3,6. 0,01 = 0,036 (mol)
→
(M)
1,398
Bài 19: Hiđrat hóa anken (có xúc tác) thu được một ancol duy nhất có công thức C4H9OH. Anken là
A. 2 – metylbut – 2 – en;
B. but – 2 – en;
C. 2 – metylpropen;
D. but – 1 – en.
Lời giải:
Đáp án đúng là: B
But – 2 – en có cấu tạo đối xứng, khi cộng nước thu được 1 ancol duy nhất:
Bài 20: Tinh chế bột sắt từ hỗn hợp bột sắt và bột nhôm bằng phương pháp hóa học?
Lời giải:
Cho hỗn hợp trên vào dung dịch NaOH dư ta thu được một phần chất rắn không tan, lọc bỏ phần chất rắn không tan ta thu được sắt.
Phương trình hoá học:
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2
Bài 21: Khi cho dung dịch NaOH vào dung dịch Ca(HCO3)2 thấy có
A. bọt khí và kết tủa trắng;
B. không hiện tượng gì;
C. kết tủa trắng xuất hiện;
D. kết tủa trắng sau đó kết tủa tan dần.
Lời giải:
Đáp án đúng là: C
Khi cho dung dịch NaOH vào dung dịch Ca(HCO3)2 thấy có kết tủa trắng xuất hiện vì xảy ra phản ứng sau:
2NaOH + Ca(HCO3)2 → Na2CO3 + CaCO3↓ + 2H2O
Lời giải:
Gọi phản ứng = x (mol, x > 0)
→ phản ứng = 242. x (g)
Phương trình hoá học:
Theo PTHH:
mchất rắn = dư + = 72,6 – 242x + 80x = 53,16 → x = 0,12
Hiệu suất phản ứng của quá trình nhiệt phân là:
Bài 23: Tính pH của dung dịch NH4Cl 0,10M? (biết Ka() )= 5,56.10-10). Bỏ qua sự phân li của nước.
Lời giải:
0,1……….0,1….0,1 (mol)
Gọi nồng độ phân li là x (M, x > 0)
PTHH:
Ban đầu: 0,1…………….0…………0 M
Phân li: x………………x………...x M
Kết thúc: 0,1 – x …………...x…….......x M
->
Bài 24: Để điều chế cao su Buna người ta có thể thực hiện theo các sơ đồ biến hóa sau:
C2H6 C2H4 C2H5OH Buta-1,3-đien Cao su Buna.
Tính khối lượng etan cần lấy để có thể điều chế được 5,4 kg cao su Buna theo sơ đồ trên?
A.15,625 kg;
B. 62,50 kg;
C. 46,875 kg;
D. 31,25 kg.
Lời giải:
Đáp án đúng là: B
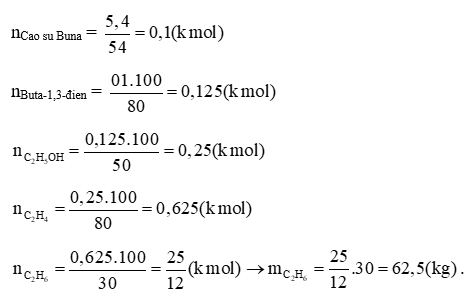
A. 1;
B. 12;
C. 13;
D. 2.
Lời giải:
Đáp án đúng là: A
Theo định luật bảo toàn điện tích cho dung dịch X và Y, lần lượt ta có:
0,07. 1 = 0,02. 2 + x. 1 → x = 0,03
0,04. 1 = y. 1 → y = 0,04
Phương trình hoá học:
H+ + → H2O
0,04 0,03
Bài 26: Công thức hóa học của chất được tạo bởi Fe (II) và O là:
A. Fe3O2;
B. Fe3O4;
C. Fe2O3;
D. FeO.
Lời giải:
Đáp án đúng là: D
Gọi công thức hoá học tạo bởi Fe (II) và O là FexOy
Theo quy tắc hoá trị, ta có: II. x = II. y
→ Công thức hoá học cần tìm là FeO.
Bài 27: Trong phản ứng: 2Ag + Cl2 → 2AgCl↓. Chọn phát biểu đúng:
A. Ag là chất khử
B. Ag là chất oxi hóa
C. Ag vừa là chất khử, vừa là chất oxi hóa
D. Ag không là chất khử, cũng không là chất oxi hóa
Lời giải:
Đáp án đúng là: A
Vì Ag → Ag+ + 1e nên Ag là chất khử trong phản ứng trên.
Lời giải:
A. pentan;
B. iso – pentan;
C. neo – penan;
D. 2,2 – đimetylpropan.
Lời giải:
Đáp án đúng là: B
Lời giải
Phương trình hoá học:
Theo PTHH:
Vhỗn hợp khí = (0,04 + 0,01). 22,4 = 1,12 (l)
Bài 31: Biết N = 14 đvC. Phân từ khối của khí nitrogen N2 là:
A. N2 = 28 đvC;
B. N2 = 14 đvC;
C. N2 = 20 đvC;
D. N2 = 7 đvC.
Lời giải
Đáp án đúng là: A
Phân từ khối của khí nitrogen N2 là 14. 2 = 28 đvC.
Bài 32: Dung dịch H2SO4 có nồng độ H2SO4 0,005M thì pH bằng bao nhiêu?
Lời giải:
0,005……0,01
Bài 33: Hãy tính khối lượng của 5,6 lít khí N2 ở đktc?
Lời giải:
Vậy khối lượng của 5,6 lít khí N2 ở đktc là 7 gam.
Bài 34: Viết công thức cấu tạo của Fe2(SO4)3?
Lời giải:
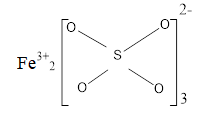
Bài 35: Cho 11,2 gam Fe vào dung dịch HCl. Tính:
a) Thể tích khí H2 thu được ở đktc?
b) Khối lượng HCl đã phản ứng?
c) Khối lượng muối FeCl2 tạo thành?
Lời giải:
Phương trình hoá học:
Fe + 2HCl → FeCl2 + H2
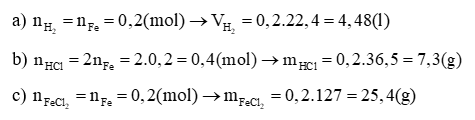
A. 40,8 ;
B. 38,0;
C. 32,4;
D. 35,2.
Lời giải:
Đáp án đúng là: D
Do nên Ag+ phản ứng hết, Fe dư
nFe phản ứng =
Chất rắn A gồm Fe dư 0,05 mol; 0,3 mol Ag
mrắn = 0,05. 56 + 0,3. 108 = 35,2 gam
a. Xác định CTHH của các muối X, Y.
b. Tính m và thể tích khí C ở đktc ứng với giá trị E lớn nhất.
Lời giải:
a. Cho AgNO3 vào dung dịch B đã axit hoá tạo ra kết tủa trắng bị hoá đen ngoài ánh sáng, đó là AgCl, vậy phải có một trong hai muối là muối clorua.
- Khi cho Ba(OH)2 mà có khí bay ra chứng tỏ đó là NH3. Vậy muối Y phải là muối amoni (muối trung hoà hoặc muối axit)
- Mặt khác khi thêm Ba(OH)2 tới dư mà vẫn còn kết tủa chứng tỏ một trong hai muối phải là muối sunfat
Các phản ứng dạng ion:
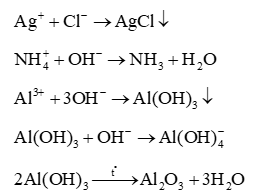
(không đổi khi nung)
Sự chênh lệch nhau vì khối lượng khi nung E, F là do Al2O3 tạo thành từ Al(OH)3
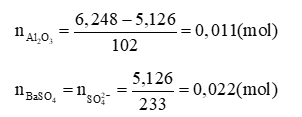
Ta thấy: nên không thể có muối Al2(SO4)3. Do đó muối nhôm phải là muối clorua AlCl3 với số mol = 0,011. 2 = 0,022 mol và muối Y phải là (NH4)2SO4 hoặc NH4HSO4 với số mol là 0,022 mol.
b.
- Trường hợp muối (NH4)2SO4
m = 0,022. 133,5 + 0,022. 132 = 5,841 gam
nkhí C = = 0,044 (mol) → VB = 0,9856 lít
- Trường hợp muối NH4HSO4
m = 0,022. 133,5 + 0,022. 115 = 5,467 gam
nkhí C = = 0,022 (mol) → VB = 0,4928 lít
A. 3 lớp electron, 3 electron lớp ngoài cùng;
B. 3 lớp electron, 5 electron lớp ngoài cùng;
C. 3 lớp electron, 4 electron lớp ngoài cùng;
D. 2 lớp electron, 5 electron lớp ngoài cùng.
Lời giải:
Đáp án đúng là: C
Nguyên tử silicon có 14 electron sẽ sắp xếp lần lượt như sau:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Còn lại 14 – 2 – 8 = 4 electron ở lớp thứ ba
A. 31,6 gam;
B. 32,6 gam;
C. 30,6 gam;
D. 29,6 gam.
Lời giải:
Đáp án đúng là: A
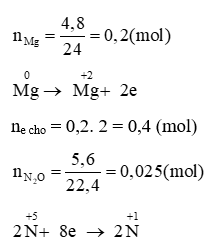
ne nhận = 0,025. 8 = 0,2 (mol) < ne cho
→ Sản phẩm có muối amoni:
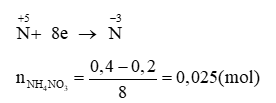
Chất rắn khan gồm NH4NO3: 0,025 mol; Mg(NO3)2: 0,2 mol
→ m = 0,025. 80 + 0,2. 148 = 31,6 (g)
Bài 40: Viết lại các công thức sau cho đúng: Na2H2PO4; Mg2(HSO3)3; NH4Cl2
Lời giải:
Công thức đúng là: NaH2PO4, Mg(HSO3)2, NH4Cl
Lời giải:
Ở cả 2 trường hợp, lượng kết tủa thu được bằng nhau mà:
nên trường hợp 1: CO2 hết, Ba(OH)2 dư, chỉ xảy ra 1 phản ứng: CO2 + Ba(OH)2 → BaCO3↓ + H2O
Ở trường hợp 2, xảy ra 2 phản ứng sau:
CO2 + Ba(OH)2 → BaCO3↓ + H2O (*)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (**)
→
Theo PTHH (*), (**),
Bài 43: Cho phản ứng hóa học sau: M + HNO3 → M(NO3)n + NO↑ + H2O.
Hệ số cân bằng của phản ứng lần lượt là:
A. 3, 4n, 3, 2n, 2n;
B. 2, 4n, 2, n, 2n;
C. 3, 4n, 3, 2n, n;
D. 3, 4n, 3, n, 2n.
Lời giải:
Đáp án đúng là: D
3M + 4nHNO3 → 3M(NO3)n + nNO↑ + 2nH2O.