Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu NO2 + H2O → HNO3 + NO, tài liệu bao gồm có định nghĩa, công thức tính và các dạng bài tập, giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho kì thi môn Hóa sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Phương trình NO2 + H2O → HNO3 + NO
1. Phương trình hóa học
3NO2 + H2O → 2HNO3 + NO
2. Hiện tượng nhận biết phản ứng
Khi cho NO2 tác dụng với nước tạo ra axit nitric và khí không màu, hóa nâu trong không khí.
3. Tính chất của NO2
3.1. Tính chất vật lí
3.2. Tính chất hóa học
- NO2 tham gia vào phản ứng oxy hóa khử:
3NO2 + H2O → 2HNO3 + NO
(Trong phản ứng này ta thấy NO2 vừa là chất oxy hóa vừa là chất khử).
- NO2 tham gia vào phản ứng quang hóa trong điều chế NO
NO2+ hv (λ < 430 nm) → NO + O
4. Tính chất của H2O
4.1. Tính chất vật lí
Nước có các tính chất vật lý sau:
Ở trạng thái lỏng, nước nguyên chất không màu, không mùi, không vị và không có hình dạng nhất định.
Nhiệt độ sôi là 100 độ C, (p = 760 mmHg), nhiệt độ hóa rắn là 0 độ C.
Nước có khối lượng riêng ở 4 độ C bằng 1g/ml.
Đây là dung môi phân cực và có thể hoà tan được nhiều chất tan phân cực ở cả trạng thái rắn, lỏng và khí như: đường, muối ăn, khí amoniac, axit…
Nước tinh khiết không có tính dẫn điện. Tuy nhiên các loại nước thông thường có chứa nhiều loại muối tan nên có khả năng dẫn điện, tính dẫn điện này phụ thuộc vào tổng lượng muối có trong nước và tính chất của muối cũng như nhiệt độ hiện tại của nước.
4.2. Tính chất hóa học
Tính chất hóa học của nước trong chương trình hóa 8 được thể hiện qua 3 điểm sau đây.
Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca.. tạo thành bazo và khí H2.
2Na + 2H2O → 2NaOH + H2 ↑
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
Nước tác dụng với oxit bazo tạo thành bazo tương ứng. Dung dịc bazo làm quỳ tím hóa xanh.
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
5. Bài tập vận dụng
Câu 1. Quá trình nào dưới đây không làm giảm lượng oxi trong không khí?
A. Sự gỉ của các vật dụng bằng sắt ngoài không khí
B. Sự quang hợp của cây xanh trong tự nhiên
C. Sự cháy của than, củi, bếp ga
D. Sự hô hấp của động vật con người
Lời giải:
Đáp án: B
Giải thích:
Quá trình không làm giảm lượng oxi trong không khí là: Sự quang hợp của cây xanh.
Vì sự quang hợp của cây xanh là quá trình sản sinh ra khí oxi
Câu 2. Trong công nghiệp bằng cách nào sau đây để sản xuất khí nitơ?
A. Chưng cất phân đoạn không khí lỏng
B. Nhiệt phân NH4NO3
C. Dùng phương pháp dời nước
D. Nhiệt phân muối amoni clorua NH4Cl
Lời giải:
Đáp án: A
Giải thích:
Điều chế nito trong công nghiệp (cũng giống oxi) là chưng cất phân đoạn không khí lỏng, hạ nhiệt độ rất thấp để hóa lỏng không khí, loại tạp chất rồi tăng dần để thu N2 và O2
Câu 3. Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm đựng sẵn dung dịch Al2(SO4)3. Hiện tượng quan sát được trong quá trình phản ứng là:
A. Có kết tủa keo trắng xuất hiện, sau đó kết tủa lại tan dần
B. Có kết tủa keo màu trắng xuất hiện
C. Có kết tủa màu xanh lục xuất hiện, sau đó kết tủa lại tan dần
D. Có kết tủa màu xanh lục xuất hiện
Lời giải:
Đáp án: B
Giải thích:
6NH3 + Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
Xuất hiện kết tủa trắng
Câu 4. Oxit phi kim nào dưới đây không phải là oxit axit?
A. CO2
B. N2O5
C. P2O5
D. NO
Lời giải:
Đáp án: D
Câu 5. Dãy kim loại nào dưới đây không phản ứng với HNO3 đặc nguội
A. Al, Zn, Fe
B. Al, Cr, Fe
C. Cu, Ag, Cr
D. Cu, Cr, Fe
Lời giải:
Đáp án: B
Câu 6. Khí nào dưới đây gây ra hiện tượng mưa axit?
A. H2
B. NH3
C. CH4
D. SO2
Lời giải:
Đáp án: D
Câu 7.Trong phòng thí nghiệm, người ta điều chế HNO3 từ?
A. NH3 và O2
B. NaNO3 và H2SO4 đặc
C. NaNO3 và HCl đặc
D. NaNO2 và H2SO4 đặc.
Lời giải:
Đáp án: B
Giải thích:
NaNO3tinh thể và H2SO4đặc NaHSO4 + HNO3
Câu 8. Đem nung hỗn hợp A gồm: x mol Fe và 0,15 mol Cu, trong không khí một thời gian, thu được 63,2 gam hỗn hợp B, gồm hai kim loại trên và hỗn hợp các oxit của chúng. Đem hòa tan hết lượng hỗn hợp B trên bằng dung dịch HNO3 đậm đặc, thì thu được 0,6 mol NO2. Trị số của x là:
A. 0,7 mol
B. 0,6 mol
C. 0,5 mol
D. 0,4 mol
Lời giải:
Đáp án: A
Giải thích:
nO = y mol; nFe = x mol
56x + 0,15.64 + 16y = 63,2 (1);
3x + 0,15.2 = 2y + 0,6 (2)
Từ 1, 2 => x = 0,7 và y = 0,9
Câu 9.Đốt cháy 11,2 gam bột Fe trong bình đựng O2 thu được 14,72 gam hỗn hợp X gồm Fe2O3, Fe3O4 và Fe. Hòa tan hoàn toàn lượng hỗn hợp X bằng dung dịch HNO3 thu được V lít hỗn hợp khí Y gồm NO và NO2. Tỉ khối của B so với H2 bằng 19. Thể tích V ở đktc là:
A. 1792 ml
B. 672 ml.
C. 448 ml.
D. 896 ml.
Lời giải:
Đáp án: A
Giải thích:
MX = 19.2 = 38
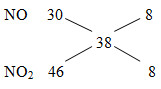
=> nN2= nNO2 = x
mFe + mO = moxit
=> mO = moxit - mFe = 14,72 - 11,2 = 3,52 gam
=> nO= 0,22 mol
Fe0 → Fe3+ + 3e
0,2 → 0,6
O0 + 2e →O2-
0,22 → 0,44
N+5 + 3e → N+2
3x x
N+5 +1e → N+4
x x
Bảo toàn e: 0,6 = 0,44 + 3x + x =0,44+4x => x= 0,04
=> nkhí = 2x = 0,08 mol
=> Vkhí = 0,08.22,4 = 1,792 lít = 1792 ml
Câu 10. Cho 30 gam hỗn hợp X gồm: Fe; FeO; Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư được 5,6 lít khí NO (đktc, sp khử duy nhất) và dung dịch Y. Số mol của HNO3 đã phản ứng là:
A. 1 mol
B. 1,45 mol
C. 1,6 mol
D. 1,35 mol
Lời giải:
Đáp án: C
Giải thích:
Quy đổi 30 gam hỗn hợp X thành Fe, và O. Gọi x, y lần lượt là số mol của Fe và O =>
56x + 16y = 30 (1);
3x – 2y = 0,25.3 (2);
Từ 1, 2 => x = 0,45 và y = 0,3; nHNO3 = 4.nNO + 2nO = 4.0,25 + 2.0,3 = 1,6 mol
Câu 11. Chỉ dùng H2O và điều kiện đun nóng có thể tách hổn hợp nào sau đây?
A. NH4Cl, K2CO3, KCl
B. NH4NO3, CaCO3, Na2SO4
C. NH4Cl, CaSO4, MgSO4
D. Tất cả đều thực hiện được
Lời giải:
Đáp án: C
Câu 12. Cho 150 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M. Sau phản ứng, trong dung dịch chứa các muối
A. KH2PO4 và K2HPO4.
B. KH2PO4 và K3PO4.
C. K2HPO4 và K3PO4.
D. KH2PO4, K2HPO4và K3PO4
Lời giải:
Đáp án: A
Câu 13. Cho kim loại Cu tác dụng với HNO3 đặc hiện tượng quan sát được là :
A. Khí màu nâu bay lên, dung dịch chuyển màu xanh
B. Khí không màu bay lên, dung dịch chuyển màu xanh
C. Khí không màu bay lên, dung dịch có màu nâu
D. Khí thoát ra không màu hoá nâu trong không khí, dung dịch chuyển sang màu xanh
Lời giải:
Đáp án: A
Giải thích:
Cho kim loại Cu tác dụng với HNO3 đặc hiện tượng quan sát được là: Khí màu nâu bay lên, dung dịch chuyển màu xanh
Câu 14. Hòa tan hết m gam FeS bằng một lượng tối thiểu dung dịch HNO3 (dung dịch X), thu được dung dịch Y và khí NO. Dung dịch Y hòa tan tối đa 1,92 gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Số mol HNO3 trong X là
A. 0,48.
B. 0,12.
C. 0,36.
D. 0,24.
Lời giải:
Đáp án: D
Giải thích:
nCu = 0,03 mol
Ta có: 2Fe3+ + Cu → 2Fe2+ + Cu2+
=> nFe3+(Y) =0,6 mol => nFeS = 0,6 mol
FeS → Fe3+ + S+6 + 9e
N+5 + 3e → N+2
=> Bảo toàn e: nNO =3.nFe3+ = 0,18 mol
Dung dịch Y chứa Fe2(SO4)3 và Fe(NO3)3
Bảo toàn nguyên tố S: nFe2(SO4)3=1/3.nFeS = 0,02 mol
Bảo toàn nguyên tố Fe và S :
nFeS = 2.nFe2(SO4)3 + nFe(NO3)3
=> nFe(NO3)3= 0,06 − 2.0,02 = 0,02 => nNO − 3nNO3− muối = 0,06 mol
Bảo toàn nguyên tố N: nHNO3 = nNO + nNO3− muối= 0,36 + 0,12 = 0,24 mol
Câu 15. Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được:
A. có kết tủa keo trắng tan dần đến hết.
B. có kết tủa keo trắng rồi tan, sau đó lại có kết tủa.
C. có kết tủa keo trắng, không thấy kết tủa tan.
D. dung dịch trong suốt.
Lời giải:
Đáp án: C
Giải thích:
Dẫn NH3vào dung dịch AlCl3 có phản ứng hóa học sau:
AlCl3 + 3NH3 + 3H2O → Al(OH)3+ 3NH4Cl
Vì NH3 là bazo yếu nên không thể hòa tan được hidroxit Al(OH)3
=> Hiện tượng: Có kết tủa keo trắng không tan
Câu 16. Dãy các chất nào sau đây tác dụng với HNO3đặc nóng đều xảy ra phản ứng oxi hóa khử là
A. Fe, FeO, Fe(OH)2, Fe(OH)3
B. Fe, FeO, Fe(NO3)2, FeCO3
C. Fe, FeSO4, Fe2(SO4)3, FeCO3
D. Fe, FeO, Fe(NO3)2, Fe(NO3)3
Lời giải:
Đáp án: B
Phản ứng oxi hóa khử xảy ra khi Fe trong hợp chất chưa đạt số oxi hóa tối đa
Mà trong Fe(OH)3 , Fe2(SO4)3,Fe(NO3)3sắt có số oxi hóa +3 => A, C, D sai
Phương trình phản ứng minh họa cho đáp án đúng
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 ↑ + 3H2O
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Fe(NO3)2 + 2 HNO3 → Fe(NO3)3 + NO2 + H2O
FeCO3 + 4 HNO3 → Fe(NO3)3 + CO2 + NO2 + 2 H2O
Câu 17. Hãy cho biết dãy hóa chất nào sau đây khi phản ứng với HNO3 đặc nóng đều thu được khí NO2 bay ra?
Fe2O3, CuS, NaNO2, NaI.
Lời giải:
Đáp án: B