Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Liên kết ion là gì? 20 Bài tập Liên kết ion có đáp án, tài liệu bao gồm có định nghĩa, công thức tính và các dạng bài tập, giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho kì thi môn Hóa sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Liên kết ion là gì? 20 Bài tập Liên kết ion có đáp án
1. Khái niệm về liên kết
1.1 Khái niệm về liên kết
- Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
1.2. Quy tắc bát tử
- Trong các nguyên tử khí hiếm, nguyên tử heli chỉ có 2 electron nên có 2 electron ở lớp thứ nhất cũng là lớp ngoài cùng, còn các nguyên tử khí hiếm khác để có 8 electron ở lớp ngoài cùng.
⇒ Như vậy, cấu hình với 8 electron ở lớp ngoài cùng (hoặc 2 electron đối với heli) là cấu hình electron vững bền.
- Theo quy tắc bát tử (8 electron) thì nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron vững bền của các khí hiếm với 8 electron (hoặc 2 đối với heli) ở lớp ngoài cùng.
2. Liên kết ion
2.1. Sự hình thành ion
- Trong phản ứng hóa học, khi nguyên tử, phân tử thêm hoặc mất bớt electron nó sẽ tạo thành các phần tử mang điện được gọi là ion. Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo thành hợp chất chứa liên kết ion.
- Điều kiện hình thành liên kết ion:
+ Liên kết được hình thành giữa các nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
+ Quy ước hiệu độ âm điện giữa hai nguyên tử liên kết ≥ 1,7 là liên kết ion (trừ một số trường hợp).
- Dấu hiệu cho thấy phân tử có liên kết ion:
+ Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim điển hình (phi kim nhóm VIIA và Oxi).
Ví dụ: Các phân tử NaCl, MgCl2, BaF2, … đều chứa liên kết ion, là liên kết được hình thành giữa các cation kim loại và anion phi kim.
+ Phân tử hợp chất muối chứa cation hoặc anion đa nguyên tử.
Ví dụ: Các phân tử NH4Cl, MgSO4, AgNO3, … đều chứa liên kết ion, là liên kết được hình thành giữa cation kim loại hoặc amoni và anion gốc axit.
- Đặc điểm của hợp chất ion: Các hợp chấy ion có nhiệt độ nóng chảy và nhiệt độ sôi cao, dẫn điện khi tan tròn nước hoặc nóng chảy.
- Ion được chia thành cation và anion:
Cation: Ion dương
Anion: Ion âm
a. Sự tạo thành cation
- Ion mang điện tích dương gọi là ion dương hay cation.
- Nếu các nguyên tử nhường bớt electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích dương hay còn gọi là cation.
Ví dụ: Sự hình thành Cation của nguyên tử Li(Z = 3)
Cấu hình e: 1s22s1
1s22s1 → 1s2 + 1e
(Li) (Li+)
Hay: Li → Li+ + 1e
Li+ gọi là cation liti.
b. Sự tạo thành anion
- Ion mang điện tích âm gọi là ion âm hay anion.
- Nếu các nguyên tử nhận thêm electron khi tham gia phản ứng hóa học nó sẽ trở thành các phần tử mang điện tích âm hay còn gọi là anion.
Ví dụ: Sự hình thành anion của nguyên tử F(Z = 9)
Cấu hình e: 1s22s22p5
1s22s22p5 + 1e → 1s22s22p6
(F) (F–)
Hay: F + 1e → F–
F-gọi là anion florua.
c. Ion đơn nguyên tử và ion âm đa nguyên tử
- Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử. Thí dụ cation Li+, Na+, Mg2+, Al3+và anion F -, Cl-, S2-, ……
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm . Thí dụ: cation amoni NH4+, anion hidroxit OH-, anion sunfat SO42–, …….
2.2. Sự tạo thành liên kết ion
a. Sự tạo thành liên kết ion của phân tử 2 nguyên tử
Xét sự hình thành liên kết ion trong phân tử natri clorua (NaCl)
Hai ion được tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl:
Na+ + Cl- → NaCl
b. Sự tạo thành liên kết ion trong phân tử nhiều nguyên tử
Xét sự hình thành liên kết ion trong phân tử CaCl2:
Các ion Ca2+ và Cl- tạo thành mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử CaCl2:
Ca2+ + 2Cl- → CaCl2
Vậy: Liên kết ion là liên kết được tạo thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Liên kết ion được hình thành giữa kim loại điển hình và phi kim điển hình.
3. Tinh thể mạng ion
3.1. Khái niệm về tinh thể
- Tinh thể được cấu tạo từ những nguyên tử, hoặc ion, hoặc phân tử.
Các hạt này được sắp xếp một cách đều đặn, tuần hoàn theo một trật tự nhất định trong không gian tạo thành mạng tinh thể.
- Các tinh thể thường có hình dạng không gian xác định.
3.2. Mạng tinh thể ion
Tinh thể NaCl được tạo bởi rất nhiều ion Na+ và Cl-, không có phân tử NaCl riêng biệt.
Được mô phỏng như hình dưới đây:
3.3. Tính chất chung của hợp chất ion
- Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng tinh thể, có tính biền vững, thường có nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
- Các hợp chất ion chỉ tồn tại ở dạng phân tử riêng rẽ khi chúng ở trạng thái hơi.
- Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy và khi hòa tan trong nước, chúng dẫn điện, còn ở trạng thái rắn thì không dẫn điện.
4. Bài tập vận dụng
Câu 1. Hợp chất ion thường được tạo thành từ
A. kim loại điển hình với khí hiếm.
B. hai nguyên tố phi kim điển hình.
C. kim loại điển hình với phi kim điển hình.
D. hai nguyên tố kim loại điển hình.
Đáp án: C
Giải thích:
Kim loại điển hình phản ứng rất mạnh với phi kim điển hình tạo ra hợp chất ion. Khi đó, nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation) còn nguyên tử phi kim nhận electron để trở thành ion mang điện tích âm (anion).
Câu 2. Phát biểu nào sau đây là đúng?
A. Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation).
B. Nguyên tử kim loại nhận electron để tạo thành ion mang điện tích dương (cation).
C. Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích âm (anion).
D. Nguyên tử kim loại nhận electron để tạo thành ion mang điện tích âm (anion).
Đáp án: A
Giải thích:
Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation).
Ví dụ:
Cấu hình electron của nguyên tử Na (Z = 11): 1s22s22p63s1
Có 1 electron ở lớp ngoài cùng.
Nguyên tử Na nhường đi 1 electron ở lớp ngoài cùng để tạo thành ion dương Na+ (cation sodium).
Na Na+ + 1e
Câu 3. Phát biểu nào sau đây là đúng?
A. Nguyên tử phi kim nhường electron để tạo thành ion mang điện tích âm (anion).
B. Nguyên tử phi kim nhận electron để tạo thành ion mang điện tích âm (anion).
C. Nguyên tử phi kim nhường electron để tạo thành ion mang điện tích dương (cation).
D. Nguyên tử phi kim nhận electron để tạo thành ion mang điện tích dương (cation).
Đáp án: B
Giải thích:
Nguyên tử phi kim nhận electron để tạo thành ion mang điện tích âm (anion).
Ví dụ: Cấu hình electron của nguyên tử Cl (Z = 17): 1s22s22p63s23p5.
® Có 7 electron ở lớp ngoài cùng.
Nguyên tử Cl nhận 1 electron để tạo thành ion âm Cl- (anion chloride).
Cl + 1e Cl-
Câu 4. Số đơn vị điện tích của ion dương (cation) bằng
A. số electron của nguyên tử ban đầu.
B. số electron mà nguyên tử đã nhường.
C. số lớp electron của nguyên tử.
D. số neutron của nguyên tử.
Đáp án: B
Giải thích:
Số đơn vị điện tích của ion dương (cation) bằng số electron mà nguyên tử đã nhường.
Các ion thường có cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với nguyên tố tạo thành ion đó trong bảng tuần hoàn.
Câu 5. Số đơn vị điện tích của ion âm (anion) bằng
A. số electron mà nguyên tử đã nhận.
B. số electron mà nguyên tử đã nhường.
C. số lớp electron của nguyên tử.
D. số phân lớp electron của nguyên tử.
Đáp án: A
Giải thích:
Số đơn vị điện tích của ion âm (anion) bằng số electron mà nguyên tử đã nhận.
Các ion thường có cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với nguyên tố tạo thành ion đó trong bảng tuần hoàn.
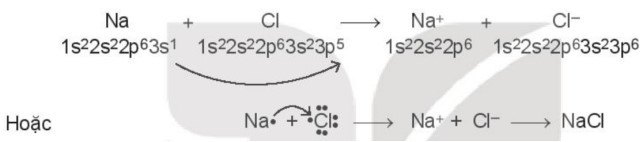
Câu 6. Để tạo thành liên kết hóa học trong phân tử sodium chloride (NaCl):
A. kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na+ và Cl-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
B. kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na- và Cl+, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
C. kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na2+ và Cl-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
D. kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na+ và Cl2-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Đáp án: A
Giải thích:
Xét sự tạo thành liên kết hóa học trong phân tử sodium chloride (NaCl):
Khi kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na+ và Cl-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Câu 7. Để tạo thành thành liên kết hóa học trong phân tử calcium chloride (CaCl2):
A. kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca+ và Cl-. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
B. kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca2+ và Cl-. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
C. kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca2- và Cl+. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
D. kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca- và Cl+. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Đáp án: B
Giải thích:
Xét sự thành thành liên kết hóa học trong phân tử calcium chloride (CaCl2):
Khi kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca2+ và Cl-. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.

Câu 8. Phát biểu nào sau đây không đúng?
A. Trong tinh thể ion, các ion sắp xếp hỗn độn, không theo một trật tự xác định.
B. Trong tinh thể ion, ở các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên.
C. Trong tinh thể ion, số ion cùng dấu bao quanh một ion trái dấu phụ thuộc vào kiểu mạng lưới tinh thể, số điện tích và kích thước của ion.
D. Trong tinh thể ion, các ion liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy (các ion cùng dấu đẩy nhau).
Đáp án: A
Giải thích:
Cấu trúc của tinh thể ion:
Các ion được sắp xếp theo một trật tự xác định trong không gian theo kiểu mạng lưới, trong đó ở các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên, liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy (các ion cùng dấu đẩy nhau), tạo thành mạng tinh thể ion.
Câu 9. Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là
A. chất rắn, dễ nóng chảy, dễ bay hơi ở điều kiện thường.
B. chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
C. chất lỏng, khó bay hơi ở điều kiện thường.
D. chất lỏng, dễ bay hơi ở điều kiện thường.
Đáp án: B
Giải thích:
Tron tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
Các tinh thể ion khá rắn chắc, nhưng khá giòn. Đây là tính chất đặc trưng của tinh thể ion.
Câu 10. Phát biểu nào sau đây không đúng?
A. Tinh thể ion khá rắn chắc nhưng khá giòn.
B. Các hợp chất ion thường tan nhiều trong nước.
C. Ở trạng thái rắn, hợp chất ion dẫn điện tốt.
D. Ở trạng thái nóng chảy, hợp chất ion dẫn điện tốt.
Đáp án: C
Giải thích:
Ở trạng thái rắn, các ion không di chuyển tự do được nên hợp chất ion không dẫn điện. Tuy nhiên, ở trạng thái nóng chảy, các ion có thể chuyển động khá tự do nên hợp chất ion dẫn điện.
Câu 11. Hoàn thành sơ đồ tạo thành ion sau: K K+ + ?.
A. 1e.
B. 2e.
C. 3e.
D. 4e.
Đáp án: A
Giải thích:
Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation). Số đơn vị điện tích của ion dương (cation) bằng số electron mà nguyên tử đã nhường.
Sơ đồ tạo thành ion: K ® K+ + 1e.
Câu 12. Hoàn thành sơ đồ tạo thành ion sau: O +2e ?
A. O2+.
B. O2-.
C. O-.
D. O+.
Đáp án: B
Giải thích:
Nguyên tử phi kim nhận electron để tạo thành ion mang điện tích âm (anion). Số đơn vị điện tích của ion âm (anion) bằng số electron mà nguyên tử đã nhận.
Sơ đồ tạo thành ion: O +2e O2-.
Câu 13. Nguyên tử Mg có Z = 12. Cấu hình electron của ion Mg2+ là
A. 1s22s22p63s2.
B. 1s22s22p63s1.
C. 1s22s22p6.
D. 1s22s22p63s23p2.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2.
Nguyên tử Mg nhường 2 electron để tạo thành ion Mg2+: Mg ® Mg2+ + 2e.
® Cấu hình electron của ion Mg2+ là 1s22s22p6 (giống khí hiếm Neon).
Câu 14. Nguyên tử S có Z = 16. Cấu hình electron của ion S2- là
A. 1s22s22p63s23p4.
B. 1s22s22p63s2.
C. 1s22s22p63s23p6.
D. 1s22s22p6.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử S (Z = 16): 1s22s22p63s23p4.
Nguyên tử S nhận thêm 2 electron để tạo thành ion S2-: S + 2e ® S2-.
® Cấu hình electron của ion S2- là 1s22s22p63s23p6 (giống khí hiếm argon).
Câu 15. Liên kết ion trong phân tử hay tinh thể được tạo thành
A. nhờ lực đẩy giữa các ion âm.
B. nhờ lực hút tĩnh điện của các ion mang điện tích trái dấu.
C. nhờ lực đẩy giữa các ion dương.
D. giữa hai nguyên tử, trong đó có một nguyên tử nguyên tố oxygen.
Đáp án: B
Giải thích:
Lực hút tĩnh điện giữa các ion mang điện trái dấu trong phân tử (hay tinh thể) tạo ra liên kết ion.
Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình. Các hợp chất tạo nên từ các ion được gọi là những hợp chất ion.