Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Cân bằng phản ứng hóa học bằng phương pháp thăng bằng electron, tài liệu bao gồm có định nghĩa, công thức tính và các dạng bài tập, giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho kì thi môn Hóa sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Cân bằng phản ứng hóa học bằng phương pháp thăng bằng electron
1. Phương pháp thăng bằng electron dựa trên nguyên tắc
Trong phản ứng oxi hoá - khử luôn tồn tại đồng thời chất oxi hoá (chất nhận e) và chất khử (chất nhường e).
Tổng số electron do chất khử nhường phải đúng bằng tổng số electron mà chất oxi hóa nhận
2. Quy tắc xác định số Oxi hóa
● Quy tắc 1: Số oxi hóa của các nguyên tố trong đơn chất bằng 0.
● Quy tắc 2: Trong hầu hết các hợp chất :
- Số oxi hóa của H là +1 (trừ các hợp chất của H với kim loại như NaH, CaH2, thì H có số oxi hóa –1).
- Số oxi hóa của O là –2 (trừ một số trường hợp như H2O2, F2O, oxi có số oxi hóa lần lượt là : –1, +2).
● Quy tắc 3: Trong một phân tử, tổng đại số số oxi hóa của các nguyên tố bằng 0. Theo quy tắc này, ta có thể tìm được số oxi hóa của một nguyên tố nào đó trong phân tử nếu biết số oxi hóa của các nguyên tố còn lại.
● Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng đại số số oxi hóa của các nguyên tử trong ion đó bằng điện tích của nó.
> Chú ý:
Để biểu diễn số oxi hóa thì viết dấu trước, số sau, còn để biểu diễn điện tích của ion thì viết số trước, dấu sau.
Ví dụ: Số oxi hóa Fe+3 còn ion sắt (III) ghi Fe3+.
Nếu điện tích là 1+ (hoặc 1–) có thể viết đơn giản là + (hoặc -) thì đối với số oxi hóa phải viết đầy đủ cả dấu và chữ (+1 hoặc –1).
Trong hợp chất, số oxi hóa của kim loại kiềm luôn là +1, kiềm thổ luôn là +2 và nhôm luôn là +3.
3. Phương pháp thăng bằng electron
Bước 1. Xác định số oxi hoá của những nguyên tố thay đổi số oxi hoá
Bước 2. Viết quá trình oxi hoá và quá trình khử, cân bằng mỗi quá trình:
+ Dấu "+e" đặt bên có số oxi hoá lớn.
+ Số e = số oxi hoá lớn - số oxi hoá bé.
+ Nhân cả quá trình với chỉ số của nguyên tố thay đổi số oxi hoá nếu chỉ số khác 1 (với các đơn chất có thể chấp nhận giữ nguyên chỉ số).
Bước 3: Tìm hệ số thích hợp sao cho tổng số e cho bằng tổng số e nhận:
+ Tìm bội chung nhỏ nhất của số e nhường và nhận.
+ Lấy bội chung nhỏ nhất chia cho số e ở từng quá trình được hệ số.
Bước 4. Đặt hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng và kiểm tra lại.
4. Ví dụ cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron
Ví dụ 1: Cân bằng phản ứng oxi hóa – khử sau:
P + O2 → P2O5
Hướng dẫn cân bằng phản ứng oxi hóa khử
Bước 1: Xác định sự thay đổi số oxi hóa của các nguyên tố trong phản ứng
P0 + O02 → P+52O-25
Bước 2. Viết quá trình oxi hoá và quá trình khử, cân bằng mỗi quá trình:
|
Quá trình oxi hóa Quá trình khử |
P0 → P+5 +5e O20 + 2e → 2O-2 |
Bước 3: Tìm hệ số thích hợp sao cho tổng số e cho bằng tổng số e nhận:
|
x4 x5 |
P0 → P+5 +5e O20 + 2e → 2O-2 |
Bước 4. Đặt hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng và kiểm tra lại.
4P + 5O2 → 2P2O5
Ví dụ 2: Cân bằng phản ứng oxi hóa – khử sau:
Cu + HNO3→ Cu(NO3)2 + NO + H2O
Hướng dẫn cân bằng phản ứng oxi hóa khử
Bước 1: Xác định sự thay đổi số oxi hóa của các nguyên tố trong phản ứng
Cuo + HN+5O3→ Cu+2(NO3)2+ N+2O + H2O
Bước 2, 3: Ta có thể gộp bước 2, 3 lại với nhau
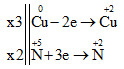
Bước 4. Đặt hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng và kiểm tra lại.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Ví dụ 3: Cân bằng phản ứng oxi hóa – khử sau:
Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Hướng dẫn cân bằng phản ứng oxi hóa khử
Bước 1: Xác định sự thay đổi số oxi hóa của các nguyên tố trong phản ứng
Fe+8/33O4 + H+5NO3 → Fe(NO3)3 + N+2O + H2O
Bước 2 + 3: Viết quá trình oxi hoá và quá trình khử, tìm hệ số thích hợp sao cho tổng số e cho bằng tổng số e nhận
|
Quá trình oxi hóa: x3 Quá trình khử: x1 |
Fe3(+8/3) → 3Fe(+3) + 1e N(+5) + 3e →N(+2) |
Bước 4. Đặt hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng và kiểm tra lại.
Fe3O4 là chất bị oxi hóa, HNO3 vừa là môi trường vừa là chất bị khử.
Cứ 28 phân tử HNO3 tham gia phản ứng chỉ có 1 phân tử đóng vai trò là chất bị khử, 27 phân tử còn lại đóng vai trò là môi trường.
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Ví dụ 4: Cân bằng phản ứng oxi hóa – khử sau
FeSO4 + K2Cr2O7+ H2SO4 → Fe2(SO4)3+ K2SO4 + Cr2(SO4)2+ H2O.
Hướng dẫn cân bằng phương trình oxi hóa khử
Fe+2SO4 + K2Cr+62O7 + H2SO4→ Fe2+3(SO4)3 + K2SO4 + Cr2+3(SO4)2 + H2O.
|
Quá trình oxi hóa: 6x Quá trình khử: 1x |
Fe2+ → Fe3+ + 1e 2Cr6+ + 2.3e → 2Cr+3 |
Hay 6FeSO4 + K2Cr2O7→ 3Fe2(SO4)3 + Cr2(SO4)3
Kiểm tra hai vế: thêm K2SO4 vào về phải; thêm 7H2SO4 vào vế trái → thêm 7H2O vào vế phải.
⇒ 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3+ K2SO4 + Cr2(SO4)2 + 7H2O
Ví dụ 5. Cân bằng phản ứng oxi hóa – khử sau:
Fe3O4+ HNO3→ Fe(NO3)3+ NxOy+ H2O
Hướng dẫn cân bằng phương trình oxi hóa khử
Bước 1: Xác định số oxi hóa của một số nguyên tố thay đổi trong phản ứng trên:
+8/3Fe3O4 + HN+5O3 → Fe+3(NO3)3 + +2y/xNxOy + H2O
Bước 2: Quá trình oxi hóa và quá trình khử là:
|
Quá trình oxi hóa: 5x - 2y Quá trình khử: 1 |
+8/3Fe3 → 3Fe3+ + 1e +2y/xNx + (5x-2y)e → xN+2y/x |
Vậy phương trình hóa học được cân bằng là:
(5x - 2y) Fe3O4 + (46x - 18y) HNO3 → 3(5x - 2y) Fe(NO3)3 + NxOy + (23x - 9y)H 2O
5. Bài tập vận dụng
Câu 1. Cho 5,6 gam Fe tan hoàn toàn trong dung dịch H2SO4 đặc nóng, sau phản ứng thu được V lít SO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 3,36 lít
C. 4,48 lít
D. 2,24 lít
Hướng dẫn giải chi tiết
nFe= 5,6/56=0,1 mol
Quá trình nhường e
Fe0 → Fe+3 + 3e
0,1 → 0,3
Quá trình nhận e
S+6 + 2e → S+4
0,3 0,15
=> VSO2 = 0,15.22,4 = 3,36 lít
Câu 2. Cho 11,2 gam Fe tan hoàn toàn trong dung dịch HNO3 loãng dư, sau phản ứng thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Hướng dẫn giải chi tiết
Số mol của sắt bằng:
nFe = 0,2 mol.
Phương trình phản ứng minh họa liên quan
Fe + 4HNO3 → Fe(NO3)3 + NO↑+ 2H2O
=> nNO = 0,2
=> VNO = 0,2.22,4 = 4,48 lít.
Câu 3. Hoà tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là:
A. hỗn hợp gồm Al2O3 và Fe2O3
B. hỗn hợp gồm BaSO4 và Fe2O3
C. hỗn hợp gồm BaSO4 và FeO
D. Fe2O3
Hướng dẫn giải chi tiết
Phương trình phản ứng hóa học
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Fe + H 2SO4 → FeSO4 + H2
Dung dịch X gồm Al2(SO4)3 và FeSO4 + Ba(OH)2
Ba(OH)2 + Al2(SO4)3 → BaSO4↓ + Al(OH)3↓
Ba(OH)2 + Al(OH)3 → Ba(AlO2)2 + H2O
Ba(OH)2 + FeSO4 → Fe(OH)2↓ + BaSO4↓
Nung kết tủa Y được Fe2O3 và BaSO4