Với giải sách bài tập Hóa học 11 Bài 19: Carboxylic acid sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 19: Carboxylic acid
Bài 19.1 trang 60 SBT Hóa học 11: Chất có công thức CH3CH(CH3)CH2COOH có tên thay thế là
A. 2-methylpropanoic acid. B. 2-methylbutanoic acid.
C. 3-methylbutanoic acid. D. isopentanoic acid.
Lời giải:
Đáp án đúng là: C
CH3CH(CH3)CH2COOH: 3-methylbutanoic acid.
Bài 19.2 trang 60 SBT Hóa học 11: Chất có công thức CH3CH(CH3)CH2CH2COOH có tên thay thế là
A. 2-methylpentanoic acid. B. 2-methylbutanoic acid.
C. isohexanoic acid. D. 4-methylpentanoic acid.
Lời giải:
Đáp án đúng là: D
CH3CH(CH3)CH2CH2COOH: 4-methylpentanoic acid.
A. 2. B. 3. C. 4. D. 5.
Lời giải:
Đáp án đúng là: C
Các đồng phân là:
CH3(CH2)3COOH,
(CH3)2CHCH2CHO,
CH3CH2CH(CH3)CHO,
(CH3)3CCHO.
Bài 19.4 trang 61 SBT Hóa học 11: Trong các chất dưới đây, chất nào có nhiệt độ sôi cao nhất?
A. Propanol. B. Propionic aldehyde.
C. Acetone. D. Propionic acid.
Lời giải:
Đáp án đúng là: D
Nhiệt độ sôi của carboxylic acid cao hơn các alcohol có cùng số nguyên tử carbon.
A. NaOH, Cu, NaCl. B. Na, NaCl, CuO.
C. Na, Ag, HCl. D. NaOH, Na, CaCO3.
Lời giải:
Đáp án đúng là: D
Dung dịch carboxylic acid phản ứng được với các kim loại đứng trước hydrogen trong dãy hoạt động hóa học của các kim loại Þ Loại A, C.
Dung dịch carboxylic acid không phản ứng được với NaCl Þ Loại B.
Bài 19.6 trang 61 SBT Hóa học 11: Cho các phản ứng sau ở điều kiện thích hợp:
(1) Lên men giấm ethyl alcohol.
(2) Oxi hoá không hoàn toàn acetaldehyde.
(3) Oxi hoá không hoàn toàn butane.
(4) Cho methanol tác dụng với carbon monoxide.
Trong những phản ứng trên, có bao nhiêu phản ứng tạo ra acetic acid?
A. 1. B. 2. C. 3. D. 4.
Lời giải:
Đáp án đúng là: D
Cả 4 trường hợp đều tạo ra acetic acid.
A. HCHO và CH3COOH. B. C3H5(OH)3 và HCHO.
C. C3H5(OH)3 và CH3COOH. D. C2H4(OH)2 và CH3COCH3.
Lời giải:
Đáp án đúng là: C
Aldehyde và ketone không có phản ứng với Cu(OH)2 ở nhiệt độ thường.
⇒ Loại A, B, D.
Bài 19.8 trang 61 SBT Hóa học 11: Đặc điểm nào sau đây là của phản ứng ester hoá?
A. Phản ứng thuận nghịch, cần đun nóng và không cần xúc tác.
B. Phản ứng thuận nghịch, cần đun nóng và cần xúc tác.
C. Phản ứng hoàn toàn, cần đun nóng, cần xúc tác.
D. Phản ứng hoàn toàn, cần đun nóng và không cần xúc tác.
Lời giải:
Đáp án đúng là: B
Đặc điểm của phản ứng ester hoá: Phản ứng thuận nghịch, cần đun nóng và cần xúc tác.
A. Nước vôi trong. B. Giấm ăn.
C. Phèn chua. D. Muối ăn.
Lời giải:
Đáp án đúng là: A
Nước vôi trong có tính base.
Phản ứng trung hòa làm sấu bớt chua, đồng thời nước vôi trong làm sấu giòn hơn.
A. Dùng dung dịch H2SO4 đặc làm xúc tác.
B. Chưng cất ester tạo ra.
C. Tăng nồng độ acetic acid hoặc alcohol.
D. Lấy số mol alcohol và acid bằng nhau.
Lời giải:
Đáp án đúng là: D
Số mol của các chất tham gia không ảnh hưởng đến hiệu suất của phản ứng.
A. Kem đánh răng. B. Xà phòng C. Vôi. D. Giấm.
Lời giải:
Đáp án đúng là: C
Vôi giúp trung hòa acid từ trong nọc ong.
A. Cả ba ống đều có phản ứng.
B. Ống (1) và ống (3) có phản ứng, còn ống (2) thì không,
C. Ống (2) và ống (3) có phản ứng, còn ống (1) thì không.
D. Ống (1) có phản ứng, còn ống (2) và ống (3) thì không.
Lời giải:
Đáp án đúng là: C
Alcohol đơn chức không có phản ứng với Cu(OH)2.
A. CH2=CHCOOH. B. CH3COOH.
C. HC≡CCOOH. D. CH3CH2COOH.
Lời giải:
Đáp án đúng là: A
Gọi công thức của X là RCOOH.
2RCOOH + CaCO3 ⟶ (RCOO)2Ca + CO2↑ + H2O
nX = (7,28 − 5,76) : 19 = 0,08 (mol) ⟹ MX = 5,76 : 0,08 = 72 (g mol−1).
Vậy X có công thức là: CH2=CHCOOH.
A. 3,5%. B. 3,75%. C. 4%. D. 5%.
Lời giải:
Đáp án đúng là: B
Số mol của giấm ăn là: 0,025.1 = 0,025 (mol)
Khối lượng của dung dịch là: 40.1 = 40 (g)
Vậy nồng độ của mẫu giấm ăn là: = 3,75%
CO + 2H2 CH3OH (1)
CH3OH + CO CH3COOH (2)
Giả sử hiệu suất của các phản ứng (1) và (2) đều đạt 90%. Để sản xuất 1 000 lít acetic acid (D = 1,05 g mL–1), cần thể tích khí CO và H2 (ở điều kiện chuẩn) lần lượt là
A. 964,06 m3 và 1 928,12 m3. B. 535,6 m3 và 1 071,17 m3.
C. 964,06 m3 và 964,06 m3. D. 1 017,6 m3 và 1 071,2 m3.
Lời giải:
Đáp án đúng là: D
Khối lượng acetic acid cần sản xuất là: 1000.103.1,05 = 1,05.106 (g)
Số mol acetic acid cần sản xuất là: = 17,5.103 (mol)
Số mol CO ở phản ứng (2) đã sử dụng là: 17,5.103 : 90% = 19,44.103 (mol)
Số mol CO ở phản ứng (1) đã sử dụng là: 19,44.103 : 90% = 21,6.103 (mol)
⟹ Số mol H2 ở phản ứng (1) đã sử dụng là 21,6.103.2 = 43,2.103 (mol)
Vậy thể tích CO cần dùng là 1017,6 m3 và thể tích H2 cần dùng là 1 071,2 m3.
Lời giải:
- Điều chế formaldehyde từ methane:
CH4 + Cl2 CH3Cl + HCl
CH3Cl + NaOH CH3OH + NaCl
CH3OH + CuO HCHO + Cu + H2O
- Điều chế acetic acid từ methane:
Lấy CH3OH từ trên: CH3OH + CO CH3COOH
Hoặc: 2CH4 C2H2 + 3H2
C2H2 + H2O CH3CHO
CH3CHO + 2[Ag(NH3)2]OH ⟶ CH3COONH4 + 3NH3 + 2Ag + H2O
CH3COONH4 + HCl ⟶ CH3COOH + NH4Cl
Trong trường hợp trên, bạn Hiền đã sử dụng phương pháp tinh chế nào? Cách làm như vậy đã đúng chưa? Vì sao? Có thể có cách tinh chế nào khác?
Lời giải:
Cách làm như vậy là đúng. Bạn Hiền đã dùng phương pháp kết tinh, dựa trên lí do cát không tan trong nước còn benzoic acid tan tốt trong nước nóng nhưng ít tan trong nước lạnh.
Ngoài cách làm trên, có thể đun nóng hỗn hợp và ngưng tụ hơi benzoic acid bay lên thu được acid do benzoic acid thăng hoa.
Lời giải:
Các phương trình hoá học xảy ra:
a) Viết công thức cấu tạo của benzoic acid.
b) Vì sao trong thực tế người ta không sử dụng benzoic acid làm chất bảo quản mà thường dùng muối sodium benzoate?
c) Hãy viết phương trình hoá học điều chế benzoic acid từ toluene.
Lời giải:
a) Công thức cấu tạo của benzoic acid: 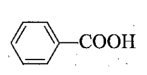
b) Do benzoic acid ít tan trong nước nên người ta thường dùng dạng muối sodium. Trong nước, tồn tại cân bằng:
Bezoic acid sinh ra trong nước với hàm lượng nhỏ có tác dụng làm chất bảo quản.
c) Tổng hợp benzoic acid từ toluene:
C6H5CH3 + 2KMnO4 C6H5COOK + 2MnO2 + KOH + H2O
C6H5COOK + HCl C6H5COOH + KCl
a) Xác định khối lượng riêng của giấm rồi so với khối lượng riêng của dung dịch mẫu pha từ CH3COOH và nước.
b) Cô cạn nước, còn lại là CH3COOH.
c) Chuẩn độ bằng dung dịch NaOH đã biết nồng độ tới khi làm hồng phenolphthalein.
Lời giải:
a) Không chính xác vì trong giấm còn có ethanol hoặc đường còn dư tuỳ theo nguyên liệu để sản xuất.
b) Không được, vì nhiệt độ sôi của CH3COOH là 118oC, gần với nhiệt độ sôi của nước.
c) Đó là cách thường làm dựa vào phản ứng:
CH3COOH + NaOH ⟶ CH3COONa + H2O
a) Trong hai chất trên, chất nào tác dụng được với NaHCO3 (biết H2CO3 có pKa1 = 6,3; pKa2 = 10,2). Viết phương trình hoá học của phản ứng xảy ra (nếu có).
b) Benzoic acid có lẫn phenol được hoà tan trong hexane. Để tách hai chất ra khỏi nhau, người ta thêm dung dịch NaHCO3 dư vào, lắc đều rồi tách riêng phần nước và phần hữu cơ. Acid hoá phần nước bằng dung dịch HCl để thu lấy chất hữu cơ A. Từ phần hữu cơ thu được chất hữu cơ B. Phương pháp nào đã được sử dụng để tách riêng hai chất benzoic acid và phenol? Cho biết tên của các chất hữu cơ A và B.
Lời giải:
a) Chỉ có benzoic acid tác dụng được với NaHCO3 do pKa (benzoic acid) < pKa2 (H2CO3):
C6H5COOH + NaHCO3 ⟶ C6H5COONa + H2O + CO2
b) Trong quy trình đã nêu, phương pháp được sử dụng để tách riêng hai chất benzoic acid và phenol là phương pháp chiết. Chất hữu cơ A thu được từ phần nước là benzoic acid; chất hữu cơ B thu được từ phần hữu cơ là phenol.
Lời giải:
Công thức cấu tạo các acid:
a) Xác định sản phẩm X trong sơ đồ tổng họp.
b) Dự đoán sản phẩm Y trong sơ đồ trên.
c) Tính thể tích methacrylic acid (D = 1,015 g mL−1) tổng hợp được từ 10 m3 acetone (D = 0,7844 g mL−1) theo sơ đồ trên. Giả thiết hiệu suất mỗi giai đoạn là 80%.
Lời giải:
a) X là 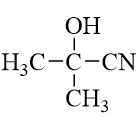
b) Y là NH4HSO4.
c) Khối lượng acetone: 10.106.0,7844 = 7,844.106 (g).
Khối lượng methacrylic acid thu được tính theo lí thuyết:
(g)
Vì hiệu suất mỗi giai đoạn là 80% nên khối lượng methacrylic acid thực thu được:
(g)
Thể tích methacrylic acid thu được là:
(g) = 5,867 tấn.
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Lý thuyết Carboxylic acid
I. Khái niệm và danh pháp
1. Khái niệm
- Carboxylic acid là những hợp chất hữu cơ mà trong phân tử chứa nhóm carboxyl (-COOH) liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
- Công thức chung của carboxylic acid no, đơn chức, mạch hở: CnH2n+1COOH (n≥0).
2. Danh pháp
- Danh pháp thay thế monocarboxylic acid mạch hở:
Tên carboxylic acid = Tên hydrocarbon (bỏ e) + oic + acid
- Một số carboxylic acid cũng có tên thông thường.
II. Tính chất vật lý
- Ở điều kiện thường, các carboxylic acid đều ở thể lỏng hoặc rắn.
- Nhiệt độ sôi của carboxylic acid cao hơn của các alcohol có cùng số nguyên tử carbon.
- Các carboxylic acid có C1-C3 tan vô hạn trong nước, khi số nguyên tử carbon tăng thì độ tan giảm dần.
III. Tính chất hóa học
1. Tính acid
- Dung dịch carboxylic acid làm quỳ tím chuyển thành màu đỏ.
a) Phản ứng với kim loại.
- Dung dịch caroxylic acid phản ứng được với các kim loại đứng trước hydrogen.
CH3COOH + Mg → (CH3COO)2Mg + H2
b) Phản ứng với base và oxide base
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + MgO → (CH3COO)2Mg + H2O
c) Phản ứng với muối
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
2. Phản ứng ester hóa
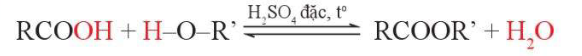
IV. Ứng dụng và điều chế
1. Ứng dụng
- Carboxylic acid có nhiều ứng dụng trong các lĩnh vực như: thực phẩm, dược phẩm, mỹ phẩm, y tế, phẩm nhuộm, tổng hợp hữu cơ,…
- Acetic acid dùng làm giấm; dùng trong công nghiệp dệt, dược phẩm, sản xuất nước hoa,…
2. Điều chế
- Trong công nghiệp, các carboxylic acid được sản xuất bằng phương pháp oxi hóa các alkane:
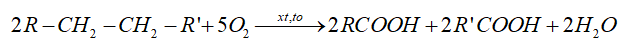
- Phương pháp lên men:
