Với giải Câu hỏi 3 trang 28 Hóa học lớp 11 Kết nối tri thức chi tiết trong Bài 3: Ôn tập chương 1 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 3: Ôn tập chương 1
Câu hỏi 3 trang 28 Hóa học 11: Tính pH của các dung dịch sau:
a) Dung dịch NaOH 0,1 M;
b) Dung dịch HCl 0,1 M;
c) Dung dịch Ca(OH)2 0,01 M.
Lời giải:
a) NaOH → Na+ + OH-
0,1 → 0,1 M
Ta có: [H+].[OH]- = 10-14
Ta có: pH = -log[H+] = 13.
b) HCl → H+ + Cl-
0,1 → 0,1 M
Ta có: pH = -log[H+] = 1 M.
c) Ca(OH)2 → Ca2+ + 2OH-
0,01 → 0,02 M
Ta có: [H+].[OH]- = 10-14
Ta có: pH = -log[H+] = 12,3.
Công thức tính pH dung dịch
- Nồng độ H+ được dùng để đánh giá độ axit và độ kiềm của dung dịch. Tuy nhiên dung dịch thường dùng có nồng độ H+ nhỏ. Để tránh ghi nồng độ H+ với số mũ âm, người ta dùng giá trị pH với quy ước như sau :
[H+] = 10-pH M . Nếu [H+] =10-aM => pH= a
- Về mặt toán học
[H+] = 10-pH M=> pH = -lg[H+]
Bạn nên biết
- Độ axit và độ kiềm của dung dịch được đánh giá chỉ bằng nồng độ :
+ Môi trường trung tính: [ H+] = 1,0.10-7 M
+ Môi trường axit: [ H+] > 1,0.10-7 M
+ Môi trường kiềm: [ H+] < 1,0.10-7 M
- Độ axit và độ kiềm của dung dịch được đánh giá qua pH:
+ Môi trường trung tính: pH= 7
+ Môi trường axit: pH < 7
+ Môi trường kiềm: pH > 7
- Thang pH thường dùng có giá trị từ 1 đến 14.
- Giá trị của pH có ý nghĩa to lớn trong thực tế:
+ Giá trị pH trong dịch dạ dày khoảng 1,0-2,0.
+ Giá trị pH trong máu khoảng 7,30-7,45.
+ Giá trị pH trong nước để ngoài không khí là 5,5.
+…
Mở rộng
- Trong dung dịch ta luôn có tích số ion của nước không đổi:
[ H+]. [OH-] = 10-14
=> [OH-] = 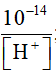 ; [H-] =
; [H-] = 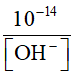
- Công tính pH theo [OH-]
pH = 14 + lg[OH-]
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Câu hỏi 1 trang 28 Hóa học 11: Hằng số KC của một phản ứng phụ thuộc vào yếu tố nào sau đây?...
Câu hỏi 3 trang 28 Hóa học 11: Tính pH của các dung dịch sau:....
Câu hỏi 4 trang 28 Hóa học 11: Viết biểu thức hằng số cân bằng KC cho các phản ứng sau:...
Câu hỏi 5 trang 28 Hóa học 11: Cho cân bằng hoá học sau:....
Câu hỏi 6 trang 28 Hóa học 11: Xét phản ứng xảy ra trong lò luyện gang:....
Câu hỏi 7 trang 28 Hóa học 11: Cho cân bằng hoá học sau:....
Xem thêm các bài giải SGK Hóa lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 2: Cân bằng trong dung dịch nước
Bài 6: Một số hợp chất của nitrogen với oxygen