Với lời giải SBT Hóa học 11 trang 64 chi tiết trong Bài 19: Carboxylic acid Cánh diều giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 19: Carboxylic acid
Bài 19.21 trang 64 SBT Hóa học 11: Benzoic acid (C6H5COOH, pKa = 4,2; ts = 249oC) và phenol (C6H5OH, pKa = 10,0; ts = 182oC) đều tan trong hexane, nhưng các muối của chúng (benzoate và phenolate) lại tan trong nước và không tan trong hexane.
a) Trong hai chất trên, chất nào tác dụng được với NaHCO3 (biết H2CO3 có pKa1 = 6,3; pKa2 = 10,2). Viết phương trình hoá học của phản ứng xảy ra (nếu có).
b) Benzoic acid có lẫn phenol được hoà tan trong hexane. Để tách hai chất ra khỏi nhau, người ta thêm dung dịch NaHCO3 dư vào, lắc đều rồi tách riêng phần nước và phần hữu cơ. Acid hoá phần nước bằng dung dịch HCl để thu lấy chất hữu cơ A. Từ phần hữu cơ thu được chất hữu cơ B. Phương pháp nào đã được sử dụng để tách riêng hai chất benzoic acid và phenol? Cho biết tên của các chất hữu cơ A và B.
Lời giải:
a) Chỉ có benzoic acid tác dụng được với NaHCO3 do pKa (benzoic acid) < pKa2 (H2CO3):
C6H5COOH + NaHCO3 ⟶ C6H5COONa + H2O + CO2
b) Trong quy trình đã nêu, phương pháp được sử dụng để tách riêng hai chất benzoic acid và phenol là phương pháp chiết. Chất hữu cơ A thu được từ phần nước là benzoic acid; chất hữu cơ B thu được từ phần hữu cơ là phenol.
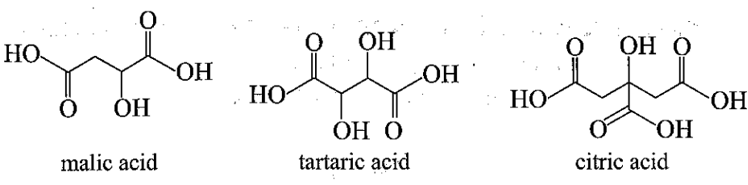
Bài 19.22 trang 64 SBT Hóa học 11: Vị chua của các trái cây là do các acid hữu cơ có trong đó gây nên. Trong quả táo có 2-hydroxybutanedioic (malic acid), trong quả nho có 2,3-dihydroxybutanedioic (tartaric acid), trong quả chanh có 2-hydroxypropane-l,2,3-tricarboxylic (citric acid hay limonic acid). Hãy viết công thức cấu tạo các acid đó.
Lời giải:
Công thức cấu tạo các acid:
Bài 19.23 trang 64 SBT Hóa học 11: Acetone được sử dụng như một nguyên liệu để tổng hợp methacrylic acid, một hợp chất được dùng nhiều trong tổng hợp thuỷ tinh hữu cơ.
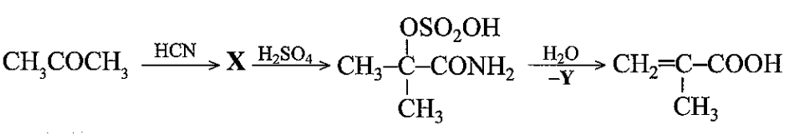
a) Xác định sản phẩm X trong sơ đồ tổng họp.
b) Dự đoán sản phẩm Y trong sơ đồ trên.
c) Tính thể tích methacrylic acid (D = 1,015 g mL−1) tổng hợp được từ 10 m3 acetone (D = 0,7844 g mL−1) theo sơ đồ trên. Giả thiết hiệu suất mỗi giai đoạn là 80%.
Lời giải:
a) X là 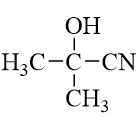
b) Y là NH4HSO4.
c) Khối lượng acetone: 10.106.0,7844 = 7,844.106 (g).
Khối lượng methacrylic acid thu được tính theo lí thuyết:
(g)
Vì hiệu suất mỗi giai đoạn là 80% nên khối lượng methacrylic acid thực thu được:
(g)
Thể tích methacrylic acid thu được là:
(g) = 5,867 tấn.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 19.1 trang 60 SBT Hóa học 11: Chất có công thức CH3CH(CH3)CH2COOH có tên thay thế là...
Bài 19.2 trang 60 SBT Hóa học 11: Chất có công thức CH3CH(CH3)CH2CH2COOH có tên thay thế là...
Bài 19.3 trang 61 SBT Hóa học 11: Số công thức cấu tạo chứa nhóm carboxylic có cùng công thức C5H10O2 là...
Bài 19.4 trang 61 SBT Hóa học 11: Trong các chất dưới đây, chất nào có nhiệt độ sôi cao nhất?...
Bài 19.5 trang 61 SBT Hóa học 11: Dung dịch acetic acid phản ứng được với tất cả các chất trong dãy nào sau đây?...
Bài 19.6 trang 61 SBT Hóa học 11: Cho các phản ứng sau ở điều kiện thích hợp:...
Bài 19.7 trang 61 SBT Hóa học 11: Cặp dung dịch nào sau đây đều có thể hoà tan Cu(OH)2 ở nhiệt độ thường?...
Bài 19.8 trang 61 SBT Hóa học 11: Đặc điểm nào sau đây là của phản ứng ester hoá?...
Bài 19.9 trang 61 SBT Hóa học 11: Một số carboxylic acid như oxalic acid, tartaric acid,… gây ra vị chua cho quả sấu xanh. Trong quá trình làm sấu ngâm đường, người ta sử dụng dung dịch nào sau đây để làm giảm vị chua của quả sấu?...
Bài 19.10 trang 62 SBT Hóa học 11: Yếu tố nào sau đây không làm tăng hiệu suất phản ứng ester hoá giữa acetic acid và ethanol?...
Bài 19.11 trang 62 SBT Hóa học 11: Formic acid (HCOOH) có trong nọc kiến, nọc ong, sâu róm. Nếu không may bị ong đốt thì nên bôi vào vết ong đốt loại chất nào sau đây là tốt nhất?...
Bài 19.12 trang 62 SBT Hóa học 11: Có ba ống nghiệm chứa các dung dịch trong suốt: ống (1) chứa ethyl alcohol, ống (2) chứa acetic acid và ống (3) chứa acetaldehyde. Nếu cho Cu(OH)2/OH− lần lượt vào các dung dịch trên và đun nóng thì:...
Bài 19.13 trang 62 SBT Hóa học 11: Cho một dung dịch chứa 5,76 gam một carboxylic acid X đơn chức, mạch hở tác dụng hết với CaCO3 thu được 7,28 gam muối carboxylate. Công thức cấu tạo của X là...
Bài 19.14 trang 62 SBT Hóa học 11: Để trung hoà 40 mL giấm ăn cần 25 mL dung dịch NaOH 1 M. Biết khối lượng riêng của giấm xấp xỉ là 1 g mL−1. Mẫu giấm ăn này có nồng độ là...
Bài 19.15 trang 62, 63 SBT Hóa học 11: Acetic acid được sử dụng rộng rãi để điều chế polymer, tổng hợp hương liệu,… Acetic acid được tổng hợp từ nguồn khí than đá (giá thành rẻ) theo các phản ứng sau:...
Bài 19.16 trang 63 SBT Hóa học 11: Từ methane và các chất vô cơ cần thiết khác có thể điều chế được formaldehyde và acetic acid. Viết phương trình hoá học của các phản ứng xảy ra...
Bài 19.17 trang 63 SBT Hóa học 11: Có một mẫu benzoic acid (C6H5COOH) bị lẫn một ít cát. Để thu được acid tinh khiết, bạn Hiền đã làm như sau: Đun nóng hỗn hợp với nước đến khi lượng chất rắn không tan thêm nữa, đem lọc nhanh để thu lấy dung dịch. Để nguội thấy có tinh thể hình kim không màu của benzoic acid tách ra. Lọc lấy tinh thể, làm khô. Tiến hành tương tự hai lần nữa với tinh thể này, thu được chất rắn có nhiệt độ nóng chảy không đổi ở 120oC...
Bài 19.18 trang 63 SBT Hóa học 11: Để điều chế 2,4-dichlorophenoxyacetic acid (2,4-D) dùng làm chất diệt cỏ, chất kích thích sinh trưởng thực vật, người ta cho phenol tác dụng với chlorine, sau đó cho tác dụng với NaOH; cho sản phẩm thu được tác dụng với ClCH2COONa; cuối cùng cho tác dụng với dung dịch HCl. Hãy viết các phương trình hoá học của các phản ứng (các chất được viết ở dạng công thức cấu tạo)...
Bài 19.19 trang 63 SBT Hóa học 11: Benzoic acid thường được dùng làm chất bảo quản với hàm lượng rất thấp...
Bài 19.20 trang 63 SBT Hóa học 11: Để xác định hàm lượng acetic acid trong giấm, trong các cách nêu dưới đây, cách nào dùng được, cách nào không dùng được? Vì sao?...
Bài 19.21 trang 64 SBT Hóa học 11: Benzoic acid (C6H5COOH, pKa = 4,2; ts = 249oC) và phenol (C6H5OH, pKa = 10,0; ts = 182oC) đều tan trong hexane, nhưng các muối của chúng (benzoate và phenolate) lại tan trong nước và không tan trong hexane...
Bài 19.22 trang 64 SBT Hóa học 11: Vị chua của các trái cây là do các acid hữu cơ có trong đó gây nên. Trong quả táo có 2-hydroxybutanedioic (malic acid), trong quả nho có 2,3-dihydroxybutanedioic (tartaric acid), trong quả chanh có 2-hydroxypropane-l,2,3-tricarboxylic (citric acid hay limonic acid). Hãy viết công thức cấu tạo các acid đó...
Bài 19.23 trang 64 SBT Hóa học 11: Acetone được sử dụng như một nguyên liệu để tổng hợp methacrylic acid, một hợp chất được dùng nhiều trong tổng hợp thuỷ tinh hữu cơ...
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác:
