Lời giải bài tập Hóa học lớp 11 Bài 19: Carboxylic acid sách Cánh diều hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 19 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 19: Carboxylic acid
Lời giải:
Công thức cấu tạo của acetic acid:
Tính chất hoá học của acetic acid:
- Acetic acid có tính acid:
+ Làm quỳ tím chuyển sang màu đỏ.
+ Phản ứng với kim loại đứng trước hydrogen trong dãy hoạt động hoá học của kim loại và giải phóng khí hydrogen.
+ Phản ứng với các base và basic oxide tạo thành muối và nước.
+ Phản ứng với một số muối.
- Acetic acid có khả năng tham gia phản ứng ester hoá.
Ứng dụng của acetic acid:
Một lượng lớn acetic acid được sử dụng để sản xuất vinyl acetate và cellulose acetate. Vinyl acetate được dùng sản xuất keo dán và chất kết dính trong sản xuất giấy, sản xuất tơ (tơ vinylon), … ; cellulose acetate được sử dụng làm tá dược trong sản xuất thuốc, sản xuất tơ, phim ảnh, … Acetic acid còn được sử dụng để tổng hợp aluminium monoacetate (Al(OH)2COOCH3) làm chất cầm màu trong công nghệ dệt may, tổng hợp ethyl acetate, butyl acetate làm dung môi (để pha sơn), tổng hợp muối ammonium acetate (CH3COONH4) để sản xuất acetamide – một chất có tác dụng lợi tiểu và làm toát mồ hôi; tổng hợp phenylacetic acid dùng trong công nghiệp nước hoa, tổng hợp penicillin, tổng hợp chloroacetic acid dùng trong sản xuất chất diệt cỏ 2,4 – D và 2,4,5 – T,… Dung dịch acetic acid 2 – 5% được dùng làm giấm ăn, làm chất tẩy cặn trong siêu đun nước và nhiều ứng dụng trong đời sống hàng ngày.
I. Khái niệm và danh pháp
Luyện tập 1 trang 133 Hóa học 11: Hãy chỉ ra hợp chất carboxylic acid trong số các chất dưới đây:
CH3 – COOH (A)
CH3 – CHO (B)
HOOC – COOH (C)
CH3 – CO – CH3 (D)
CH2 = CH – COOH (E)
Lời giải:
Carboxylic acid là những hợp chất hữu cơ mà trong phân tử chứa nhóm – COOH liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
Vậy hợp chất carboxylic acid là:
CH3 – COOH (A)
HOOC – COOH (C)
CH2 = CH – COOH (E)
Lời giải:
Các carboxylic acid có cùng công thức C5H10O2:
CH3 – CH2 – CH2 – CH2 – COOH: pentanoic acid;
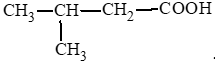
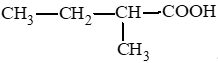
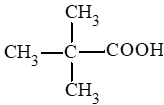
II. Tính chất vật lí
Lời giải:
Ở nhiệt độ thường, các carboxylic acid ở thể lỏng hoặc thể rắn.
Các chất có nhiệt độ nóng chảy, nhiệt độ sôi cao thể rắn ở điều kiện thường.
Tham khảo bảng sau:
Lời giải:
Chiều tăng dần nhiệt độ sôi các chất: (B), (C), (D), (A), (E).
Giải thích:
- Với các chất có phân tử khối tương đương nhau nhiệt độ sôi: hydrocarbon < aldehyde < alcohol < carboxylic acid.
- Nhiệt độ sôi của các carboxylic acid no, đơn chức, mạch hở đều tăng dần theo chiều tăng dần của phân tử khối.
Câu hỏi 2 trang 134 Hóa học 11: Vì sao acetic acid có thể tan vô hạn trong nước?
Lời giải:
Acetic acid có phân tử khối nhỏ và có khả năng tạo liên kết hydrogen với nước nên có khả năng tan vô hạn trong nước.
III. Tính chất hoá học
Lời giải:
Trong nhóm carboxyl, mật độ electron tại nhóm OH chuyển dịch về phía nhóm C = O nên nguyên tử hydrogen trong nhóm OH trở nên linh động hơn và mang một phần điện tích dương. Tương tự như aldehyde và ketone, liên kết C = O trong phân tử carboxylic acid cũng là liên kết phân cực, do đó nguyên tử carbon mang một phần điện tích dương.
Dự đoán: Carboxylic acid thể hiện tính acid và tham gia phản ứng ester hoá.
Lời giải:
Ka càng lớn thì acid càng mạnh.
Quan sát vào bảng 19.2 xác định được HCOOH có tính acid mạnh nhất trong bảng.
Thí nghiệm 1 trang 135 Hóa học 11: Khả năng đổi màu quỳ tím của acetic acid
Nhúng đầu đũa thuỷ tinh vào dung dịch acetic acid 5%, sau đó chấm vào giấy quỳ tím. Quan sát và nhận xét sự thay đổi màu của giấy quỳ tím.
Lời giải:
Giấy quỳ tím chuyển sang màu đỏ do trong nước acetic acid điện li không hoàn toàn theo cân bằng:
CH3COOH ⇌ CH3COO- + H+.
a) Zn.
b) CuO.
c) Cu(OH)2.
d) CaCO3.
Lời giải:
Các phương trình hoá học xảy ra:
a) Zn + 2CH3CH2COOH → (CH3CH2COO)2Zn + H2.
b) CuO + 2CH3CH2COOH → (CH3CH2COO)2Cu + H2O.
c) Cu(OH)2 + 2CH3CH2COOH → (CH3CH2COO)2Cu + 2H2O.
d) CaCO3 + 2CH3CH2COOH → (CH3CH2COO)2Ca + CO2 + H2O.
Thí nghiệm 2 trang 136 Hóa học 11: Phản ứng của acetic acid với magnesium
Chuẩn bị: Dung dịch CH3COOH 1 M, phoi bào magnesium; ống nghiệm.
Tiến hành: Cho 1 – 2 mL dung dịch acetic acid 1M vào ống nghiệm, sau đó thêm vào vài mẩu magnesium.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Lời giải:
Hiện tượng: Mẩu Mg tan dần, có khí không màu thoát ra.
Phương trình hoá học: Mg + 2CH3COOH → (CH3COO)2Mg + H2.
Giải thích: Kim loại Mg đứng trước hydrogen trong dãy hoạt động hoá học của các kim loại nên phản ứng được với acetic acid giải phóng khí hydrogen.
Lời giải:
Trích mẫu thử.
Cho lần lượt từng mẩu quỳ tím vào từng mẫu thử:
- Quỳ tím không đổi màu → mẫu thử là acetaldehyde.
- Quỳ tím chuyển sang màu đỏ → mẫu thử là acetic acid, acrylic acid (nhóm I).
Phân biệt nhóm I bằng dung dịch bromine:
+ Dung dịch bromine nhạt dần đến mất màu → mẫu thử là acrylic acid.
CH2 = CH – COOH + Br2 → CH2Br – CHBr – COOH.
+ Không hiện tượng → mẫu thử là acetic acid.
Lời giải:
Giấm ăn là dung dịch acetic acid có nồng độ 2 – 5%, do đó giấm ăn có thể tác dụng với CaCO3 thành phần chính của cặn bám ở đáy ấm (siêu) đun nước tạo thành muối tan. Vì thế khi có cặn màu trắng (thành phần chính là CaCO3) bám ở đáy ấm đun nước có thể dùng giấm ăn để loại bỏ các vết cặn này.
CaCO3 + 2CH3COOH → (CH3COO)2Ca + CO2 + H2O.
Thí nghiệm 3 trang 136 Hóa học 11: Phản ứng của acetic acid với sodium carbonate
Chuẩn bị: Dung dịch CH3COOH 1 M, dung dịch Na2CO3 1M; ống nghiệm, diêm.
Tiến hành: Cho 1 – 2 mL dung dịch sodium carbonate 1 M vào ống nghiệm. Nhỏ tiếp vào ống nghiệm 1 – 2 mL dung dịch acetic acid 1 M. Đưa que diêm đang cháy vào miệng ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Lời giải:
Hiện tượng: Có khí không màu thoát ra; đưa que diêm đang cháy vào miệng ống nghiệm thấy que diêm tắt.
Giải thích bằng phương trình hoá học:
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O.
Khí CO2 không duy trì sự cháy nên làm tắt que diêm đang cháy.
Lời giải:
Một số biện pháp để nâng cao hiệu suất của phản ứng ester hoá:
- Thêm chất xúc tác.
- Lấy dư một trong hai chất đầu.
- Giảm nồng độ các sản phẩm.
Lời giải:
- Không đun sôi hỗn hợp phản ứng do ethyl acetate có nhiệt độ sôi thấp, dễ bay hơi; việc đun sôi sẽ làm giảm hiệu suất phản ứng.
- Vai trò của sodium chloride bão hoà để tách ethyl acetate ra khỏi hỗn hợp.
Thí nghiệm 4 trang 137 Hóa học 11: Phản ứng điều chế ethyl acetate
Chuẩn bị: Cồn 96°, acetic acid nguyên chất, dung dịch H2SO4 đặc, dung dịch NaCl bão hoà, ống nghiệm.
Tiến hành: Cho 1 mL cồn 96° vào trong ống nghiệm. Cho tiếp vào trong ống nghiệm 1 mL acetic acid nguyên chất. Thêm vào ống nghiệm 1 – 2 giọt dung dịch sulfuric acid đậm đặc và lắc đều, dùng bông sạch nút miệng ống nghiệm. Sau đó, đun cách thuỷ trong cốc thuỷ tinh ở nhiệt độ 65 – 70 °C trong khoảng thời gian 5 – 7 phút. Làm lạnh ống nghiệm rồi cho thêm vào 2 mL dung dịch sodium chloride bão hoà. Để yên ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích.
Chú ý an toàn: Cẩn thận khi làm việc với dung dịch H2SO4 đặc.
Lời giải:
Hiện tượng: Phản ứng sinh ra chất lỏng, nhẹ hơn nước, có mùi thơm đặc trưng.
Giải thích bằng phương trình hoá học:
CH3COOH + C2H5OH CH3COOC2H5 + H2O.
Bài tập (trang 139)
Bài 1 trang 139 Hóa học 11: Hợp chất X có công thức cấu tạo: (CH3)2CHCH2COOH. Tên của X là
A. 2 – methylpropanoic acid.
B. 2 – methylbutanoic acid.
C. 3 – methylbutanoic acid.
D. 3 – methylbutan – 1 – oic acid.
Lời giải:
Đáp án đúng là: C
3 – methylbutanoic acid.
Bài 2 trang 139 Hóa học 11: Chất nào sau đây có nhiệt độ sôi cao nhất?
A. Propan – 1 – ol.
B. Acetaldehyde.
C. Formic acid.
D. Acetic acid.
Lời giải:
Đáp án đúng là: D
Nhiệt độ sôi: Acetaldehyde < Propan – 1 – ol < Formic acid < Acetic acid.
Lời giải:
Trích mẫu thử.
Cho lần lượt từng mẩu quỳ tím vào từng mẫu thử:
- Quỳ tím chuyển sang màu đỏ → mẫu thử là acetic acid.
- Quỳ tím không đổi màu → mẫu thử là ethanol, glycerol, acetaldehyde (nhóm I).
Phân biệt nhóm I, dùng Cu(OH)2/OH-.
- Ở điều kiện thường:
+ Cu(OH)2 tan, sau phản ứng thu được dung dịch màu xanh đặc trưng → mẫu thử là glycerol.
+ Không có hiện tượng: ethanol, acetaldehyde (nhóm II).
- Tiếp tục đun nóng các ống nghiệm chứa thuốc thử Cu(OH)2/OH- và mẫu thử nhóm (II).
+ Xuất hiện kết tủa đỏ gạch → mẫu thử là acetaldehyde.
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O (đỏ gạch) + 3H2O.
+ Không hiện tượng → mẫu thử là ethanol.
Lời giải:
Phương trình hoá học:
CH3COOH + C2H5OH CH3COOC2H5 + H2O.
0,2 0,3 0,2 mol
Dựa vào PTHH có C2H5OH dư nên số mol ester sinh ra theo lí thuyết tính theo số mol CH3COOH.
Hiệu suất phản ứng ester hoá là:
Hãy giúp bạn Mai xác định nồng độ mol của acetic acid trong giấm.
Lời giải:
Thể tích trung bình của dung dịch NaOH cần dùng:
Nồng độ acetic acid có trong giấm ăn là:
Lời giải:
%O = 100% - 50% - 5,56% = 44,44%.
Đặt công thức chung của X là: CxHyOz, ta có:
x : y : z =
= 4,167 : 5,56 : 2,778 = 3 : 4 : 2.
Vậy công thức đơn giản nhất của X là C3H4O2.
Công thức phân tử của X có dạng: (C3H4O2)n.
Peak của ion phân tử [M+] có giá trị m/z = 72 nên phân tử khối của X là 72.
⇒ 72n = 72 ⇒ n = 1.
Trên phổ IR của X thấy xuất hiện một peak rộng từ 2 500 – 3 200 cm-1, một peak ở 1 707 cm-1 nên X là carboxylic acid. Công thức cấu tạo của X là:
CH2 = CH – COOH.
Lý thuyết Carboxylic acid
I. Khái niệm và danh pháp
1. Khái niệm
- Carboxylic acid là những hợp chất hữu cơ mà trong phân tử chứa nhóm carboxyl (-COOH) liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
- Công thức chung của carboxylic acid no, đơn chức, mạch hở: CnH2n+1COOH (n≥0).
2. Danh pháp
- Danh pháp thay thế monocarboxylic acid mạch hở:
Tên carboxylic acid = Tên hydrocarbon (bỏ e) + oic + acid
- Một số carboxylic acid cũng có tên thông thường.
II. Tính chất vật lý
- Ở điều kiện thường, các carboxylic acid đều ở thể lỏng hoặc rắn.
- Nhiệt độ sôi của carboxylic acid cao hơn của các alcohol có cùng số nguyên tử carbon.
- Các carboxylic acid có C1-C3 tan vô hạn trong nước, khi số nguyên tử carbon tăng thì độ tan giảm dần.
III. Tính chất hóa học
1. Tính acid
- Dung dịch carboxylic acid làm quỳ tím chuyển thành màu đỏ.
a) Phản ứng với kim loại.
- Dung dịch caroxylic acid phản ứng được với các kim loại đứng trước hydrogen.
CH3COOH + Mg → (CH3COO)2Mg + H2
b) Phản ứng với base và oxide base
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + MgO → (CH3COO)2Mg + H2O
c) Phản ứng với muối
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
2. Phản ứng ester hóa
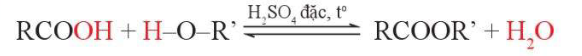
IV. Ứng dụng và điều chế
1. Ứng dụng
- Carboxylic acid có nhiều ứng dụng trong các lĩnh vực như: thực phẩm, dược phẩm, mỹ phẩm, y tế, phẩm nhuộm, tổng hợp hữu cơ,…
- Acetic acid dùng làm giấm; dùng trong công nghiệp dệt, dược phẩm, sản xuất nước hoa,…
2. Điều chế
- Trong công nghiệp, các carboxylic acid được sản xuất bằng phương pháp oxi hóa các alkane:
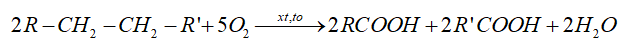
- Phương pháp lên men:

Sơ đồ tư duy Carboxylic acid
Xem thêm các bài giải SGK Hóa học lớp 11 Cánh diều hay, chi tiết khác: