Bài viết Công thức tính hằng số cân bằng hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính hằng số cân bằng từ đó biết cách làm bài tập về tính hằng số cân bằng.
Công thức tính hằng số cân bằng hay nhất
Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Vậy đại lượng nào đặc trưng cho cân bằng hóa học? Tính đại lượng đó như thế nào? Để biết được đáp án, các em không thể bỏ qua bài viết này.
1. Công thức tính hằng số cân bằng
Xét phản ứng thuận nghịch sau:
aA + bB ⇄ cC + dD
A, B, C, D là những chất khí hoặc những chất tan trong dung dịch.
Khi phản ứng ở trạng thái cân bằng, ta có:
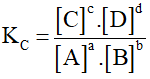
Trong đó:
Kc là hằng số cân bằng
[A], [B], [C], [D] là nồng độ mol của A, B, C, D
a, b, c, d là các hệ số trong phương trình hóa học cân bằng.
2. Bạn nên biết
- Tại trạng thái cân bằng, nồng độ các chất không đổi.
- Hằng số cân bằng Kc xác định chỉ phụ thuộc vào nhiệt độ.
- Hằng số cân bằng là đại lượng không thứ nguyên (không có đơn vị).
3. Mở rộng
Xét cân bằng trong hệ dị thể
Xét hệ cân bằng sau :
C(r) + CO₂ (k) ⇄ 2CO (k)
Nồng độ của chất rắn được coi là hằng số, nên nó không có mặt trong biểu thức hằng số cân bằng K. Đối với cân bằng trên ta có :
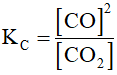
4. Ví dụ minh họa
Câu 1: Cho phản ứng sau: H2(k) + I2(k) ⇄ 2HI(k)
Nồng độ các chất lúc cân bằng ở nhiệt độ 430 như sau: [H2]=[I2]=0,107M; [HI]=0,768M. Hằng số cân bằng KC của phản ứng ở 430 là:
A. 51,96
B. 53,96
C. 51,52
D. 50,34
Hướng dẫn giải
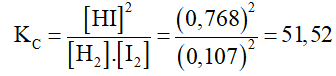
Đáp án C
Câu 2: Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở , H2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng Kc ở của phản ứng có giá trị là:
A. 2,500
B. 3,125
C. 0,609
D. 0,500
Hướng dẫn giải
Ta có: 3H3 + N2 ⇄ 2NH3 (1).
Gọi a là [N2] phản ứng.
Vậy theo phản ứng (1): [H2] phản ứng là 3a; [NH3] phản ứng là 2a.
Khi đạt đến trạng thái cân bằng: [N2] = 0,3 – a, [H2] = 0,7 – 3a
Để đơn giản ta xét 1 lít hỗn hợp.
Sau khi phản ứng đạt cân bằng: 0,3 – a + 0,7 – 3a + 2a = 1 – 2a
Mặt khác %VH2= 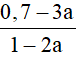 =0,5 -> a= 0,1 mol
=0,5 -> a= 0,1 mol
Khi đạt cân bằng [N2] = 0,3 – 0,1 = 0,2 (M)
[H2] = 0,7 – 0,3 = 0,4 (M)
[NH3] = 0,2 (M).
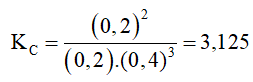
Đáp án B
Câu 3: Cho biết phản ứng sau: H₂O(k) + CO(k) ⇄ H₂(k) + CO₂(k)
Cho ở 700°C hằng số cân bằng Kc = 1,873. Tính nồng độ H2O và CO ở trạng thái cân bằng, biết rằng hỗn hợp ban đầu gồm 0,300 mol H2O và 0,300 mol CO trong bình 10 lít ở 700°C.
A. [H2O]=0,05mol/l; [CO]=0,05 mol/l
B. [H2O]=0,013mol/l; [CO]=0,013 mol/l
C. [H2O]=0,023mol/l; [CO]=0,023 mol/l
D. [H2O]=0,015mol/l; [CO]=0,015 mol/l
Hướng dẫn giải
Nồng độ các chất ban đầu là: [H2O]=0,03mol/l; [CO]=0,03 mol/l
H2O(k) + CO(k) 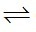 H2(k) + CO2(k)
H2(k) + CO2(k)
bd 0,03 0,03 mol/l
pu x x x x
spu 0,03-x 0,03-x x x
Ta có KC = 1,873
-> 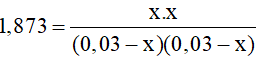
-> 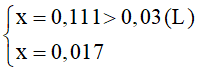
Nồng độ các chất sau phản ứng là:
[H2O]=0,013mol/l; [CO]=0,013 mol/l
Đáp án B
Câu 4: Cân bằng của phản ứng khử CO2 bằng C: C(r) + CO2 (k) ⇋ 2CO(k)
Xảy ra ở 1000K với hằng số cân bằng KP =
a) Tìm hàm lượng khí CO trong hỗn hợp cân bằng, biết áp suất chung của hệ là 2,5atm.
b) Muốn thu được hỗn hợp khí có tì khối hơi so với H2 là 18 thì áp suất chung của hệ là bao nhiêu?
Hướng dẫn giải
a) Ta có cân bằng C(r) + CO2 (k) 
Ta có:Pco+Pco2 =2,5 và Kp =
⇒ pCO = 2,071 atm; Pco2= 0,429 atm
Trong hệ cùng điều kiện nhiệt độ và thể tích ⇒ tỉ lệ về áp suất bằng tỉ lệ về số mol hay tỉ lệ về thể tích riêng. Vậy hỗn hợp lúc cân bằng chứa:
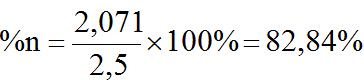
b) Khi khối lượng mol trung bình của hỗn hợp CO và CO2 là 18.2=36 thì số mol CO và CO2 bằng nhau nên ta có Pco= Pco2= 0,5P
Suy ra Kp =
Câu 5: Người ta tiến hành phản ứng: PC15 ⇋ PC13 + Cl2 trong một bình kín có dung tích không đổi ở nhiệt độ xác định. Nếu cho vào bình 0,5 mol PCl5 thì áp suất đầu là 1,5 atm. Khi cân bằng được thiết lập, áp suất đo được bằng 1,75 atm
a) Tính độ phân li và áp suất riêng của từng cấu tử.
b) Thiết lập biểu thức liên hệ giữa độ phân li và áp suất chung của hệ.
Hướng dẫn giải
Cân bằng: PCl5 ⇋ PCl3 + Cl2 (1)
Ban đầu: x
Phản ứng: αx αx αx
Cân bằng: x(1 – α) αx αx
Tổng số mol hỗn hợp khí tại thời điểm cân bằng: n= x (1 + α)
Trong cùng điều kiện nhiệt độ, thể tích hỗn hợp phản ứng không đổi nên tỉ số mol bằng tỉ lệ áp suất.
Vậy ta có:
Áp suất riêng phần của PCl5 :
Áp suất riêng phần của PCl3 = áp suất riêng phần của Cl2:
b) Theo cân bằng (1) trong hệ có thể tích và nhiệt độ không đổi thì:
PS = PT × (1 + α)
Câu 6: Trong một bình kín có dung tích không đổi, người ta thực hiện phản ứng:
Ở nhiệt độ thí nghiệm, khi phản ứng đạt tới cân bằng, ta có:PN2= 0,38atm, PH2= 0,4atm, PNH3= 2atm. Hãy tính Kp.
Hút bớt H2 ra khỏi bình một lượng cho đến khi áp suất riêng phần cửa N2 ở trạng thái cân bằng mới là 0,45atm thì dừng lại. Tính áp suất riêng phần của H2 và NH3 ở trạng thái cân bằng mới, biết rằng nhiệt độ của phản ứng không đổi.
Hướng dẫn giải
Cân bằng: N2 + 3H2 ⇋ 2NH3 (1)
Áp dụng định luật tác dụng khối lượng cho cân bằng (1):
Kp =
Khi hút bớt H2 theo nguyên lí chuyển dịch cân bằng thì cân bằng (1) sẽ chuyển dịch theo chiều nghịch (chống lại sự giảm nồng độ hay áp suất riêng phần của H2). Do đó áp suất của N2 tăng là: 0,45 – 0,38 = 0,07 (atm), do đó áp suất riêng của NH3 giảm đi bằng 2 lần áp suất của N2 tăng: 0,07×2=0,14 (atm)
Vậy áp suất riêng phần của NH3 tại thời điểm cân bằng mới là:
2 – 0,14 = 1,86 (atm)
Áp dụng định luật tác dụng khối lượng cho cân bằng (1):
Kp =
Dựa vào nguyên lí chuyển dịch cân bằng: “ Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ sẽ chuyển dịch cân bằng theo chiều làm giảm tác đọng bên ngoài.”
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Công thức xác định thành phần nguyên tử
Công thức xác định thành phần các hạt trong ion
Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học
Công thức tính phần trăm số nguyên tử mỗi đồng vị
Công thức tính bán kính nguyên tử
Công thức tính thể tích nguyên tử
Công thức oxit cao nhất, công thức hợp chất khí với hiđro các nguyên tố nhóm A
Công thức xác định hai nguyên tố thuộc hai chu kì liên tiếp trong cùng một nhóm A
Công thức xác định hai nguyên tố thuộc hai nhóm A liên tiếp trong cùng một chu kì
Công thức tính hiệu độ âm điện
Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng
Công thức tính nhanh khối lượng muối sunfat
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Công thức tính tốc độ phản ứng
Công thức tính hằng số cân bằng