Bài viết Công thức tính nhanh khối lượng muối sunfat hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính nhanh khối lượng muối sunfat từ đó biết cách làm bài tập về tính nhanh khối lượng muối sunfat.
Công thức tính nhanh khối lượng muối sunfat hay nhất
Đối với bài toán khi cho kim loại tác dụng với axit H2SO4 và yêu cầu tính khối lượng muối thu được thì làm như thế nào? Có cách giải nhanh hay không? Để biết đáp án, các em hãy đọc bài bên dưới để có câu trả lời nhé.
1. Công thức tính nhanh khối lượng muối sunfat
Dạng 1: Kim loại + H2SO4 loãng → muối sunfat + H2↑
mmuối sufat = mkim loại + 96.nH2
Dạng 2: Kim loại + H2SO4 đặc , nóng → muối sunfat +(SO2 , H2S, S)+ H2O
mmuối= mKL phản ứng + nSO42-trong muối
nSO42-trong muối = 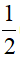 (6ns + 2nSO2 + 8nH2S ) . 96
(6ns + 2nSO2 + 8nH2S ) . 96
mmuối= mKL phản ứng + 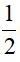 (6ns + 2nSO2 + 8nH2S ) . 96
(6ns + 2nSO2 + 8nH2S ) . 96
Lưu ý:
+ Sản phẩm khử nào không có trong phản ứng thì số mol bằng 0.
2. Bạn nên biết
- Các kim loại Al, Fe, Cr thụ động trong H2SO4 đặc , nguội.
- Đối với axit H2SO4 đặc thì sản phẩm khử thường là SO2 ( đối với các kim loại như Fe, Cu, Ag); là SO2 hoặc S hoặc H2S (đối với các kim loại có tính khử mạnh như Mg, Al, Zn, Cr)
3. Mở rộng
- Hiện tượng thụ động là axit đã oxi hóa bề mặt các kim loại tạo thành một màng oxit có tính trơ, làm cho các kim loại này thụ động. Kim loại bị thụ động sẽ không sẽ không tác dụng với các dung dịch HCl, H2SO4 loãng.
4. Bài tập minh họa
Câu 1: Hoà tan hết 1,72 gam hỗn hợp kim loại gồm Mg, Al, Zn, Fe bằng dung dịch H2SO4 loãng thu được V lít khí ở đktc và 7,48 gam muối sunfat khan. Giá trị của V là:
A. 1,344 lít
B. 1,008 lít
C. 1,12 lít
D. 3,36 lít
Hướng dẫn
Gọi nH2= x.mol -> nH2SO4 = nH2= xmol
Bảo toàn khối lượng ta có:
mm= mKL + m SO42-
-> 7,48= 1,72 + 96x
-> x= 0,06 mol
-> VH2 = 0,06.22,4= 1,344 lít
Đáp án A
Câu 2: Hoà tan hết hỗn hợp X gồm Fe và 0,24 mol kim loại M trong dung dịch H2SO4 loãng dư thu được dung dịch A và 10,752 lít khí H2 ở đktc. Cô cạn dung dịch A thu được 59,28 gam muối khan. Kim loại M là :
A. Mg
B. Ca
C. Al
D. Na
Hướng dẫn
Gọi nFe = x mol
Kim loại M nhường n electron và có nguyên tử khối là M.
nH2SO4 = nH2 = 0,48 mol
-> nSO42-= 0,48 mol
Ta có: mmuối khan = mkim loại + mSO42-
59,28 = 56x + 0,24. M + 0,48.96
56x + 0,24. M = 13,2 gam (1)
Bảo toàn electron ta có:
2x + 0,24.n=0,48.2
56x = 26,88 - 6,72n
Thay vào (1) ta được: 26,88 – 6,72 n+ 0,24.M=13,2
M= 28n - 57
-> 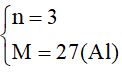
Đáp án C
Câu 3: Cho m gam Fe tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng (dư) thu được 6,72 lít khí SO2 (ở đktc). Tính khối lượng muối thu được?
A. 46 gam
B. 44 gam
C. 42 gam
D. 40 gam
Hướng dẫn
Phương trình : 2Fe + 6H2SO4 Fe2(SO4)3 + 3SO2 + 6H2O
nSO2= 0,3 mol ; nFe = 0,2 mol
Cách 1:
nFe2(SO4)3 = 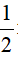 nFe = 0,1 mol
nFe = 0,1 mol
-> mFe2(SO4)3= 0,1.400= 40 gam
Cách 2:
mmuối = mkim loại + mSO42- =0,2.56+ 0,3.96=40 gam
Đáp án D
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Công thức xác định thành phần nguyên tử
Công thức xác định thành phần các hạt trong ion
Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học
Công thức tính phần trăm số nguyên tử mỗi đồng vị
Công thức tính bán kính nguyên tử
Công thức tính thể tích nguyên tử
Công thức oxit cao nhất, công thức hợp chất khí với hiđro các nguyên tố nhóm A
Công thức xác định hai nguyên tố thuộc hai chu kì liên tiếp trong cùng một nhóm A
Công thức xác định hai nguyên tố thuộc hai nhóm A liên tiếp trong cùng một chu kì
Công thức tính hiệu độ âm điện
Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng
Công thức tính nhanh khối lượng muối sunfat
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Công thức tính tốc độ phản ứng
Công thức tính hằng số cân bằng