Bài viết Công thức xác định thành phần các hạt trong ion hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức xác định thành phần các hạt trong ion từ đó biết cách làm bài tập về xác định thành phần các hạt trong ion.
Công thức xác định thành phần các hạt trong ion hay nhất
Nguyên tử luôn trung hòa về điện, nhưng khi nguyên tử nhường hay nhận thêm electron thì nó trở thành phần tử mang điện gọi là ion.
Vậy xác định thành phần các hạt trong ion bằng cách nào? Bài viết này sẽ giúp các em làm rõ vấn đề này.
1. Công thức xác định thành phần các hạt trong ion
- Sự hình thành cation: M → Mn+ + ne (với n là số electron do M nhường)
Tổng số electron của nguyên tử (phân tử) = tổng số electron của ion + n
-Sự hình thành anion: X + me → Xm- ( với m là số electron do X nhận)
Tổng số electron của nguyên tử (phân tử) = tổng số electron của ion - m
- Phương pháp: Dựa vào dữ kiện bài toán tìm mối liên hệ giữa số hạt p, số hạt e, số hạt n Tìm được ion
2. Bạn nên biết
Trong các phản ứng hóa học, để đạt được cấu hình electron bền vững của khí hiếm:
+ Nguyên tử kim loại có khuynh hướng nhường electron lớp ngoài cùng cho nguyên tử các nguyên tố khác để trở thành phần tử mang điện dương gọi là ion dương hay cation.
M → Mn+ + ne
+ Nguyên tử phi kim có khuynh hướng nhận thêm electron của nguyên tử các nguyên tố khác để trở thành phần tử mang điện âm gọi là ion âm hay anion.
X + me → Xm-
3. Mở rộng
Ngoài việc phân chia ion thành ion âm (anion) và ion dương (cation) thì ion còn được phân loại như sau:
+ Ion đơn nguyên tử: Là các ion được tạo nên từ 1 nguyên tử, ví dụ: Li+; Cl- …
+ Ion đa nguyên tử: Là nhóm các nguyên tử mang điện tích dương hay âm, ví dụ:
NH+4 ; SO2-4 .....
4. Bài tập minh họa
Câu 1: Trong anion X- có tổng số hạt cơ bản là 53, số hạt mang điện chiếm 66,04%. Xác định nguyên tố X?
A. Flo
B. Clo
C. Brom
D. Iot
Hướng dẫn
Đặt số proton, số nơtron và số electron của nguyên tử X lần lượt là p, n và e
Tổng số hạt cơ bản của anion X- là p + e + n + 1=53 hay 2p + n=52 ( do p = e).
Tổng số hạt mang điện của anion X- là p + e + 1 = 2p + 1
Ta có hệ:
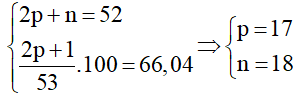
Vậy X là Clo
Đáp án B
Câu 2: Tổng số hạt mang điện âm trong ion AB43- là 50. Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22. Số hiệu nguyên tử A, B lần lượt là
A. 16 và 7
B.15 và 8
C. 7 và 16
D.8 và 15
Hướng dẫn giải:
Ion AB43- gồm 1 nguyên tử A + 4 nguyên tử B + 3 electron nên tổng số hạt mang điện âm là: ZA + 4ZB + 3 = 50 hay ZA + 4ZB = 47.
Hạt mang điện trong nguyên tử A nhiều hơn hạt mang điện trong hạt nhân nguyên tử B nên: 2ZA – ZB = 22.
Giải hệ ta được: ZA= 15 và ZB = 8.
Đáp án B
Câu 3: Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Số khối của nguyên tử M là :
A. 56.
B. 55.
C. 65.
D. 64.
Hướng dẫn giải:
M3+ là do nguyên tử M bị mất đi 3 electron hình thành.
-> M có tổng số hạt proton, nơtron, electron là : 79 + 3 = 82
Gọi số hạt proton, notron, electron của M lần lượt là: p, n, e
-> p + n + e = 82 2p + n = 82 (I)
Mặt khác, trong M3+ số hạt mang điện nhiều hơn số hạt không mang điện là 19
-> p + e - 3 – n = 19 2p – n = 22 (II)
Từ (I) và (II) -> p = 26, n = 30.
ZM =26
-> Số khối của nguyên tử M= 26+30=56
Đáp án A
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Công thức xác định thành phần nguyên tử
Công thức xác định thành phần các hạt trong ion
Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học
Công thức tính phần trăm số nguyên tử mỗi đồng vị
Công thức tính bán kính nguyên tử
Công thức tính thể tích nguyên tử
Công thức oxit cao nhất, công thức hợp chất khí với hiđro các nguyên tố nhóm A
Công thức xác định hai nguyên tố thuộc hai chu kì liên tiếp trong cùng một nhóm A
Công thức xác định hai nguyên tố thuộc hai nhóm A liên tiếp trong cùng một chu kì
Công thức tính hiệu độ âm điện
Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng
Công thức tính nhanh khối lượng muối sunfat
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Công thức tính tốc độ phản ứng
Công thức tính hằng số cân bằng