Bài viết Công thức hiđroxit cao nhất hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức hiđroxit cao nhất từ đó biết cách làm bài tập về hiđroxit cao nhất.
Công thức hiđroxit cao nhất hay nhất
Ta đã biết trong một chu kỳ khi đi từ trái qua phải theo chiều tăng của điện tích hạt nhân, tính bazơ của các hiđroxit tương ứng yếu dần, đồng thời tính axit của chúng mạnh dần. Vậy cách xác định hiđroxit cao nhất của các nguyên tố nhóm A là như thế nào? Bài viết này sẽ giúp các em giải quyết vấn đề này.
1. Công thức hiđroxit cao nhất
- Hóa trị cao nhất trong hợp chất với hiđroxit của nguyên tố nhóm A = số thứ tự nhóm.
Giả sử n là số thứ tự nhóm A. Ta có:
+ Nếu R là kim loại (n = 1, 2, 3): Công thức hiđroxit cao nhất là R(OH)n
+ Nếu R là phi kim (n = 4, 5, 6, 7): Từ công thức ban đầu R(OH)n chuyển thành HnROn.
Sau đó tiếp tục trừ đi số nguyên lần phân tử nước (H2O) đến khi công thức tới dạng HROx hoặc H2ROx thì ngưng vì nó không còn dư nước để trừ nữa.
Trừ một số trường hợp đặc biệt như: H3PO4; …
Ví dụ: Cho các nguyên tố cùng thuộc chu kì 3: 11Na, 13Al và 17Cl. Viết công thức hiđroxit cao nhất của các nguyên tố.
Hướng dẫn giải:
+) 11Na (1s22s22p63s1) → Na thuộc chu kì 3, nhóm IA → n = 1
→ Công thức hiđroxit cao nhất là NaOH.
+) 13Al (1s22s22p63s23p1) → Al thuộc chu kì 3, nhóm IIIA → n = 3
→ Công thức hiđroxit cao nhất là Al(OH)3.
+) 17Cl (1s22s22p63s23p5) → Cl thuộc chu kì 3, nhóm VIA → n = 7
Cl(OH)7 H7ClO7 HClO4.3H2O
→ Công thức hiđroxit cao nhất là HClO4
2. Bạn nên biết
- Trong 1 chu kì: từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, tính bazơ của oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
|
Nhóm |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
Oxit |
Na2O Oxit bazơ |
MgO Oxit bazơ |
Al2O3 Oxit lưỡng tính |
SiO2 Oxit axit |
P2O5 Oxit axit |
SO3 Oxit Axit |
Cl2O7 Oxit axit |
|
Hidroxit |
NaOH Bazơ mạnh kiềm |
Mg(OH)2 Bazơ yếu |
Al(OH)3 Hiđroxit lưỡng tính |
H2SiO3 Axit yếu |
H3PO4 Axit trung bình |
H2SO4 Axit mạnh |
HClO4 Axit rất mạnh |
|
Bazơ |
Axit |
||||||
- Trong 1 nhóm A : Đi từ trên xuống, theo chiều tăng dần điện tích hạt nhân tính bazơ của các oxit và hiđroxit tăng dần, tính axit giảm dần.
3. Bài tập minh họa
Câu 1: Cho các nguyên tố sau: K( Z =19) , Mg( Z =12), S( Z = 16). Công thức hiđroxit tương ứng là:
A. KOH, MgOH, H2SO4 .
B. K(OH)2, MgOH, H2SO4.
C. KOH, Mg(OH)2, H2SO3.
D. KOH, Mg(OH)2, H2SO4.
Hướng dẫn:
+) K (Z =19). Cấu hình electron của K là: 1s22s22p63s23p64s1 → K thuộc chu kì 4, nhóm IA.
→ Công thức hiđroxit cao nhất là KOH.
+) Mg (Z =12). Cấu hình electron của Mg là: 1s22s22p63s2 → Mg thuộc chu kì 3, nhóm IIA.
→ Công thức hiđroxit cao nhất là Mg(OH)2.
+) S (Z = 16). Cấu hình electron của S là: 1s22s22p63s23p4 → S thuộc chu kì 3, nhóm VIA.
S(OH)6 <-> H6SO6 <-> H2SO4.2H2O
→ Công thức hiđroxit cao nhất là: H2SO4
→ Chọn D.
Câu 2: Hiđroxit cao nhất của một nguyên tố có dạng HRO4. Biết R cho hợp chất khí với hiđro chứa 2,74%H theo khối lượng. Nguyên tố R là
A. P. B. I.
C. Br. D. Cl.
Hướng dẫn
Hiđroxit cao nhất của một nguyên tố có dạng HRO4
Giả sử gọi: n là số thứ tự nhóm A; n = 4, 5, 6, 7.
y là số nguyên lần phân tử nước.
Ta có:
HRO4.yH2O = R(OH)n
Bảo toàn nguyên tố H → 1 +2y = n
Bảo toàn nguyên tố O → 4 + y = n
→ 1 + 2y = 4 + y → y = 3, n = 7
→ R thuộc nhóm VIIA.
%mH = 2,74% = 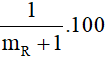
→ mR 35,5 (g/mol) → R là Cl
→ Chọn D
Câu 3: Hợp chất khí với hiđro của một nguyên tố ứng với công thức RH4. Hiđroxit cao nhất của nó chứa 3,226% H(theo khối lượng ). Nguyên tố R là
A. Si B. C
C. S D. Ca
Hướng dẫn
Hợp chất khí với hiđro của R là: RH4
→ R thuộc nhóm IVA
→ R(OH)4 <-> H4RO4 <-> H2RO3.H2O
→ Công thức hiđroxit cao nhất có dạng H2RO3
%mH = 3,226% =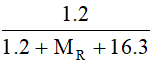 .100
.100
→ MR ≈12 (g/mol) → R là cacbon (C)
→ Chọn B.
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Công thức xác định thành phần nguyên tử
Công thức xác định thành phần các hạt trong ion
Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học
Công thức tính phần trăm số nguyên tử mỗi đồng vị
Công thức tính bán kính nguyên tử
Công thức tính thể tích nguyên tử
Công thức oxit cao nhất, công thức hợp chất khí với hiđro các nguyên tố nhóm A
Công thức xác định hai nguyên tố thuộc hai chu kì liên tiếp trong cùng một nhóm A
Công thức xác định hai nguyên tố thuộc hai nhóm A liên tiếp trong cùng một chu kì
Công thức tính hiệu độ âm điện
Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng
Công thức tính nhanh khối lượng muối sunfat
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Công thức tính tốc độ phản ứng
Công thức tính hằng số cân bằng