Bài viết Công thức tính tốc độ phản ứng hay nhất, chi tiết với bài tập minh họa có lời giải sẽ giúp học sinh nắm vững Công thức tính tốc độ phản ứng từ đó biết cách làm bài tập về tính tốc độ phản ứng.
Công thức tính tốc độ phản ứng hay nhất
Các phản ứng hoá học xảy ra nhanh, chậm rất khác nhau, nghĩa là xảy ra với tốc độ rất khác nhau. Nếu một phản ứng hoá học xảy ra chậm ở điều kiện thường thì bằng cách nào có thể tăng được tốc độ của nó lên ? Để trả lời câu hỏi trên, các em hãy đọc bài viết dưới đây.
1. Công thức tính tốc độ phản ứng
Xét phản ứng: A → B
+Tốc độ phản ứng tính theo chất A trong khoảng thời gian từ t1 đến t2 được xác định như sau:
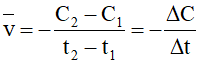
Trong đó:
Ở thời điểm t1, nồng độ chất A là C1 (mol/l);
Ở thời điểm t2, nồng độ chất A là C2 (mol/l)
+Nếu tốc độ được tính theo sản phẩm B thì
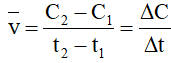
Trong đó:
Ở thời điểm t1, nồng độ chất B là (mol/l)
Ở thời điểm t2, nồng độ chất B là (mol/l).
2. Bạn nên biết
+ Tốc độ phản ứng dùng để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hóa học.
+ Tốc độ phản ứng được xác định bằng thực nghiệm.
3. Mở rộng
-Biểu thức liên hệ giữa tốc độ phản ứng và hằng số tốc độ.
Xét phản ứng: xA+yB→ sản phẩm
Tốc độ phản ứng là: v= k.[A]x[B]y
Trong đó:
k: là hằng số tốc độ phản ứng
[A], [B] là nồng độ mol của chất A, B
x, y là hệ số phương trình của A, B
-Các yếu tố ảnh hưởng đến tốc độ phản ứng:
+ Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
+ Đối với các sản phẩm có chất khí, khi tăng áp suất, tốc độ phản ứng tăng.
+ Khi tăng nhiệt độ, tốc độ phản ứng tăng. Thông thường khi nhiệt độ tăng lên 100C thì tốc độ phản ứng tăng từ 2 đến 4 lần.
+ Khi tăng diện tích tiếp xúc các chất phản ứng, tốc độ phản ứng tăng.
+ Chất xúc tác làm tăng tốc độ phản ứng, nhưng còn lại sau khi phản ứng.
4. Ví dụ minh họa
Câu 1: Cho phản ứng: 2X(khí) + Y(khí) → Z(khí) + T(khí)
Nếu áp suất của hệ tăng 3 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
A. 3 lần
B. 6 lần
C. 9 lần
D. 27 lần
Hướng dẫn:
Vban đầu = k.[X] 2.[Y] = kx2y ( với x, y là nồng độ của X, Y)
Khi áp suất của hệ tăng 3 lần thì nồng độ các chất cũng tăng gấp 3 lần .
⇒ Vsau= k.[3X] 2.[3Y]= k(3x) 2 .(3y)=27kx2y
Vậy tốc độ phản ứng tăng lên 27 lần
Đáp án D
Câu 2: Khi bắt đầu phản ứng, nồng độ một chất là 0,024 mol/l. Sau 10 giây xảy ra phản ứng, nồng độ của chất đó là 0,022 mol/l. Tốc độ phản ứng trong trường hợp này là :
A. 0,0003 mol/l.s.
B. 0,00025 mol/l.s.
C. 0,00015 mol/l.s.
D. 0,0002 mol/l.s.
Hướng dẫn
Trong trường hợp này, tốc độ của phản ứng là:
(0,024 – 0,022) : 10 = 0,0002 mol/l.s
Đáp án D
Câu 3: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10-4 mol/(l.s)
B. 5,0.10-4 mol/(l.s)
C. 1,0.10-3 mol/(l.s)
D. 5,0.10-5 mol/(l.s)
Hướng dẫn giải
2H2O  O2 + 2H2O
O2 + 2H2O
nO2 = 1,5.10-3 mol
Theo phương trình: = 3.10-3 mol
Tốc độ phản ứng là
v= = 5.10-4 mol/(l.s)
Đáp án B
Xem thêm các Công thức Hóa học lớp 10 quan trọng hay khác:
Công thức xác định thành phần nguyên tử
Công thức xác định thành phần các hạt trong ion
Công thức tính nguyên tử khối trung bình của các nguyên tố hóa học
Công thức tính phần trăm số nguyên tử mỗi đồng vị
Công thức tính bán kính nguyên tử
Công thức tính thể tích nguyên tử
Công thức oxit cao nhất, công thức hợp chất khí với hiđro các nguyên tố nhóm A
Công thức xác định hai nguyên tố thuộc hai chu kì liên tiếp trong cùng một nhóm A
Công thức xác định hai nguyên tố thuộc hai nhóm A liên tiếp trong cùng một chu kì
Công thức tính hiệu độ âm điện
Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng
Công thức tính nhanh khối lượng muối sunfat
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Công thức tính tốc độ phản ứng
Công thức tính hằng số cân bằng