Với giải sách bài tập Hóa học 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base
Bài 3.1 trang 10 SBT Hóa học 11: Điền thông tin thích hợp vào chỗ trống trong mỗi câu dưới đây
Ở 25oC, [H+][OH–] = …(1)… luôn đúng đối với các dung dịch nước. Khi [H+] …(2)… 1,0.10–7 M thì dung dịch có tính acid; khi [H+] nhỏ hơn …(3)… thì dung dịch có tính base; khi [H+] = 1,0.10–7 M, dung dịch …(4)… Dung dịch acid có …(5)… nhỏ hơn 1,0.10–7 M, dung dịch base có [OH–] lớn hơn …(6)… và dung dịch trung tính có [OH–] = …(7)….
Lời giải:
(1) 1,0.10-14; (2) lớn hơn; (3) 1,0.10-7 M; (4) trung tính;
(5) [OH–] ; (6) 1,0.10-7 M; (7) 1,0.10-7 M.
Bài 3.2 trang 10 SBT Hóa học 11: Những phát biểu nào dưới đây là đúng?
(a) Để so sánh mức độ acid giữa các dung dịch có thể dựa vào nồng độ: dung dịch acid nào có nồng độ lớn hơn sẽ có tính acid mạnh hơn.
(b) Trong các dung dịch có cùng nồng độ, dung dịch nào có tính acid mạnh hơn sẽ có nồng độ ion H+ lớn hơn và pH lớn hơn.
(c) Trong các dung dịch có cùng nồng độ, dung dịch nào có nồng độ ion OH– lớn hơn và pH nhỏ hơn sẽ có tính base lớn hơn.
(d) Trong các dung dịch có cùng nồng độ, dung dịch nào có tính acid mạnh hơn sẽ có nồng độ ion H+ lớn hơn và pH nhỏ hơn.
(e) Trong các dung dịch có cùng nồng độ, dung dịch có nồng độ ion H+ nhỏ và pH cao sẽ có tính acid yếu hơn.
(g) Trong một dãy các dung dịch có cùng nồng độ được sắp xếp theo tính acid tăng dần thì nồng độ ion OH– sẽ giảm dần và Ka tăng dần.
Lời giải:
Đáp án đúng là: (d), (e), (g).
Phát biểu (a) sai vì căn cứ so sánh là [H+] hoặc pH.
Phát biểu (b) sai vì pH càng nhỏ tính acid của dung dịch càng mạnh.
Phát biểu (c) sai vì pH càng lớn tính base của dung dịch càng mạnh.
|
Cột A |
Cột B |
|
a) Nồng độ ion OH– giảm dần |
1. Tính acid tăng dần |
|
b) pH tăng dần |
2. Tính base tăng dần |
|
c) Nồng độ ion H+ tăng dần |
|
|
d) Nồng độ ion H+ giảm dần |
|
|
e) pH giảm dần |
|
|
g) Nồng độ ion OH– tăng dần |
Đề xuất cách có thể thực hiện để làm tăng tính acid hoặc làm tăng tính base của dung dịch từ dung dịch trung tính. Bằng cách nào để có thể biết được tính acid hoặc tính base tăng lên?
Lời giải:
Đáp án đúng là: a, c, e – 1; b, d, g – 2.
Sử dụng acid mạnh thêm vào dung dịch trung tính đê làm tăng tính acid. Dùng giấy chỉ thị acid – base để thử thấy màu giấy vàng đậm dần rồi sang đỏ nếu môi trường acid rất mạnh.
Sử dụng base mạnh thêm vào dung dịch trung tính để làm tăng tính base. Dùng giấy chỉ thị acid – base để thử thấy màu giấy chỉ thị acid – base xanh đậm dần rồi chuyển tím nếu môi trường base rất mạnh.
A. 2,3 M. B. 11,7 M.
C. 5,0.10-3 M. D. 2,0.10-12 M.
Lời giải:
Đáp án đúng là: D
Ta tính được nồng độ H+ theo công thức [H+] = 10–pH.
(a) Nồng độ ion H+ của dung dịch giảm 20 lần.
(b) Nồng độ ion OH– của dung dịch khi pH = 5 là 10-9 M.
(c) Nồng độ ion H+ của dung dịch khi pH = 3 là 10-3 M.
(d) Dung dịch ban đầu là một acid có nồng độ 0,001 M.
(e) Dung dịch ban đầu là một base có nồng độ 0,001 M.
Lời giải:
Đáp án đúng là: (a), (e).
Phát biểu (a) sai vì nồng độ ion H+ của dung dịch giảm 100 lần.
Phát biểu (e) sai vì dung dịch ban đầu là một acid có nồng độ 0,001 M.
A. 1,1.10-11 M. B. 3,06 M.
C. 8,7.10-4 M. D. 1,0.10-14 M.
Lời giải:
Đáp án đúng là: C
Ta tính được nồng độ OH– theo công thức [OH–] = 10–pOH (pH + pOH = 14).
Lời giải:
Lời giải:
Số mol H+ trong 50 mL HBr là: 0,05.0,050 = 2,5.10-3 (mol).
Số mol H+ trong 150 mL HI là: 0,15.0,100 = 1,5.10-2 (mol).
Nồng độ H+ của dung địch X là:
[H+] = = 0,0875 (M);
pH = –lg(0,0875) = 1,06.
Lời giải:
Số mol NaOH thêm vào là 2,5.10-3 mol; số mol HCl ban đầu là 5.10-3 mol.
Dựa vào phương trình: H+ + OH– ⟶ H2O, tính được số mol H+ trong dung dịch thu được sau khi thêm NaOH là 2,5.10-3 mol.
Vậy pH = = 1,48.
Lời giải:
Nồng độ OH– là: (M).
Nồng độ của Ba(OH)2 tương ứng là: 2,285.10-4 (M).
Để thu được 125 mL dung dịch Ba(OH)2 thì khối lượng Ba(OH)2 cần hoà tan là:
2,285.10-4.125.10-3.171 = 4,884.10-3 (g).
A. Trước khi chuẩn độ, pH của hai acid bằng nhau.
B. Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị pH bằng 7.
C. Cần cùng một thể tích sodium hydroxide để đạt đến điểm tương đương.
D. Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương.
Lời giải:
Đáp án đúng là: C
Cả hydrochloric acid và ethanoic acid (acetic acid) đều là acid đơn chức nên khi các thể tích và nồng độ bằng nhau của các acid này được chuẩn độ bằng sodium hydroxide thì cần cùng một thể tích base để đạt đến điểm tương đương.
A. 2,80. B. 2,71. C. 2,40. D. 3,00.
b) Chuẩn độ 100,0 mL dung dịch NaOH 0,1 M bằng dung dịch HCl 1,0 M. Thể tích dung dịch HCl cần thêm để dung dịch thu được có pH = 12 là
A. 8,91 mL. B. 8,52 mL. C. 9,01 mL. D. 8,72 mL.
Lời giải:
a) Đáp án đúng là: B
Số mol OH– trong 50 mL KOH là: 0,10.0,050 = 5.10-3 (mol).
Số mol H+ trong 52 mL HNO3 là: 0,10.0,052 = 5,2.10-3 (mol).
Nồng độ H+ trong cốc A là:
[H+] = (M); pH = -lg(1,96.10-3) = 2,71.
b) Đáp án đúng là: A
Số mol OH– trong 100 mL NaOH là: 0,10.0,1 = 0,01 (mol).
Ta có pH = 12 ⇒ [H+] = 10-12 M ⇒ [OH–] = 10-2 M.
Gọi số mol H+ trong dung dịch HCl 1,0 M là x (x > 0)
Nồng độ OH– sau khi chuẩn độ là:
[OH–] = ⇒ x = 8,91.10-3 (mol)
Vậy thể tích dung dịch HCl cần thêm vào dung dịch là 8,91 mL.
Lời giải:
Phương trình hoá học của các phản ứng xảy ra như sau:
2NaOH + H2SO4 ⟶ Na2SO4 + 2H2O
HCl + NaOH ⟶ NaCl + H2O
Số mol NaOH thêm vào 100 mL dung dịch H2SO4 là: 0,05.0,213 = 1,065.10-2 (mol). Số mol NaOH được trung hoà bởi HCl là: 0,01321.0,103 = 1,361.10-3 (mol).
Số mol NaOH được trung hoà bởi 100 mL dung dịch H2SO4 là:
1,065.10-2 – 1,361.10-3 = 9,289.10-3 (mol).
Vậy nồng độ H2SO4 trong mẫu phân tích là:
b) Trong một thí nghiệm khác, Lan thực hiện chuẩn độ 10,00 mL HCl 0,020 M. Một lần nữa, Lan rất ngạc nhiên khi chỉ cần 5,00 mL một base mạnh cùng nồng độ 0,020 M để phản ứng hoàn toàn với 10,00 mL HCl đó. Em hãy giải thích cho Lan vì sao không cần một lượng tương đương là 10,00 mL base mà chỉ cần 5,00 mL?
Lời giải:
a) Acid đó là acid hai lần acid.
b) Base có khả năng nhận 2 proton (chứa hai nhóm –OH). Ví dụ Ca(OH)2, Ba(OH)2.
a1) Tính pH của dung dịch sulfuric acid (cho rằng H2SO4 là acid mạnh phân li trong nước hoàn toàn cả hai proton H+).
a2) Thêm nước vào đến vạch của bình định mức thu được 100 mL dung dịch. Xác định pH của dung dịch đã pha loãng.
b) Viết phưong trình hoá học của phản ứng giữa sulfuric acid với dung dịch sodium hydroxide.
c) Dung dịch pha loãng ở phần a2 được dùng để chuẩn độ 25,0 mL dung dịch sodium hydroxide 1,00.10-4 M.
c1) Dự đoán hiện tượng quan sát được khi chuẩn độ đạt đến điểm tương đương nếu dùng phenolphthalein làm chất chỉ thị cho phép chuẩn độ trên.
c2) Xác định thể tích acid cần dùng khi phép chuẩn độ kết thúc.
Lời giải:
a)
a1) [H+] = 2.5.10-3 = 10-2 (M); pH = –lg(10-2) = 2.
a2) pH = 3 vì dung dịch được pha loãng 10 lần.
b) Phương trình hoá học của phản ứng xảy ra:
H2SO4 + 2NaOH ⟶ Na2SO4 + 2H2O
c)
c1) Nhỏ 1 giọt phenolphthalein vào dung dịch NaOH, dung dịch có màu hồng. Chuẩn độ bằng dung dịch H2SO4, màu hồng sẽ nhạt dần, khi đạt tới điểm tương đương sẽ mất màu.
c2) Thể tích dung dịch acid cần dùng là:
Lời giải:
Khí carbon dioxide tan trong nước theo phương trình hoá học sau:
Neu con người tiếp tục phát thải CO2, các cân bằng trên chuyển dịch tạo ra nhiều [H+] hơn, làm pH của nước biển giảm, tức là nước biển càng bị acid hoá. Điều này ảnh hưởng đến môi trường sinh sống của các sinh vật biển. Nếu pH của nước biển càng thấp có thể dẫn đến sự hoà tan của các rạn san hô, vỏ sò, vỏ hàu,…
HbH+(aq) + O2(aq) ⇌ HbO2(aq) + H+(aq)
Độ pH của máu người bình thường được kiểm soát chặt chẽ trong khoảng 7,35 – 7,45. Dựa vào cân bằng trên, giải thích vì sao việc kiểm soát pH của máu người lại quan trọng. Điều gì sẽ xảy ra với khả năng vận chuyển oxygen của hồng cầu nếu máu trở nên quá acid (một tình trạng nguy hiểm được gọi là nhiễm toan hay nhiễm độc acid)?
Lời giải:
Oxygen được dẫn truyền trong cơ thể là do khả năng liên kết của oxygen với hồng cầu trong máu theo cân bằng sau:
HbH+(aq) + O2(aq) ⇌ HbO2(aq) + H+(aq) (1)
Theo nguyên lí chuyển dịch cân bằng Le Chatelier, néu nồng độ H+ tăng, cân bằng (1) sẽ chuyển dịch sang trái; nếu nồng độ H+ giảm, cân bằng (1) sẽ chuyển dịch sang phải. Vì vậy, nếu pH của máu quá thấp (nồng độ H+ cao), cân bằng sẽ chuyển dịch sang trái. Điều này khiến trong máu có ít HbO2, nên khả năng vận chuyển oxygen của hồng cầu sẽ giảm.
Bài 3.18 trang 13 SBT Hóa học 11: Acetic acid (CH3COOH) là một acid yếu.
a) Thế nào là một acid yếu? Viết phương trình hoá học của phản ứng giữa acetic acid với nước.
b) Giải thích vì sao giấm ăn (thành phần chính là acetic acid) thường được dùng để làm sạch cặn bám ở đáy ấm đun nước hoặc phích nước được dùng để chứa nước sôi.
Lời giải:
a) Acid yếu không phân li hoàn toàn;
CH3COOH + H2O ⇌ CH3COO– + H3O+
b) Giấm ăn là CH3COOH có nồng độ 2 – 5%, do đó có thể tác dụng với lớp cặn (thường là MgCO3, CaCO3) để tạo thành muối tan, dễ bị rửa trôi.
2CH3COOH + MgCO3 → (CH3COO)2Mg + CO2 + H2O.
2CH3COOH + CaCO3 ⟶ (CH3COO)2Ca + CO2 + H2O.
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 5: Một số hợp chất quan trọng của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate
Lý thuyết pH của dung dịch. Chuẩn độ acid – base
I. pH của dung dịch, chất chỉ thị
1. pH của dung dịch
|
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
3. Xác định pH bằng chất chỉ thị
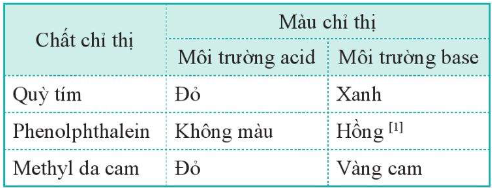
II. Chuẩn độ dung dịch acid và base
Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.