Với giải sách bài tập Hóa học 11 Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Bài 2.1 trang 7 SBT Hóa học 11: Điền từ ngữ thích hợp vào các chỗ trống trong mỗi phát biểu sau:
a) Quá trình phân li của các chất khi tan trong nước thành các ion được gọi là ...(1)... Chất điện li là chất khi tan trong nước phân li thành các ...(2).... ...(3).... là chất khi tan trong nước không phân li thành các ion.
b) Theo thuyết Brønsted – Lowry, ...(1)... là những chất có khả năng cho H+, ...(2).... là những chất có khả năng nhận H+. Acid mạnh và base mạnh phân li …(3)… trong nước; acid yếu và base yếu phân li …(4)… trong nước.
Lời giải:
a) (1) sự điện li; (2) ion; (3) Chất không điện li.
b) (1) acid; (2) base; (3) hoàn toàn; (4) một phần.
A. 5. B. 3. C. 6. D. 2.
Lời giải:
Đáp án đúng là: A
Các chất tạo dung dịch dẫn điện là: NaOH, HCl, HNO3, NaNO3, KA1(SO4)2.12H2O.
Bài 2.3 trang 7 SBT Hóa học 11: Phương trình mô tả sự điện li của NaCl trong nước là
Lời giải:
Đáp án đúng là: C
NaCl là chất điện li nên khi hòa tan vào nước sẽ tạo ra các ion.
Phương trình điện li:
Bài 2.4 trang 7 SBT Hóa học 11: Phương trình mô tả sự điện li của Na2CO3 trong nước là
Lời giải:
Đáp án đúng là: C
Na2CO3 là chất điện li nên khi hòa tan vào nước sẽ tạo ra các ion.
A. Acid mạnh. B. Base mạnh.
C. Acid yếu. D. Nước.
Lời giải:
Đáp án đúng là: A
Acid mạnh có khả năng nhường được nhiều H+ hơn acid yếu do phân li hoàn toàn trong nước.
Bài 2.6 trang 8 SBT Hóa học 11: Đặc điểm nào sau đây là không đúng khi mô tả về acid mạnh?
A. Phân li hoàn toàn trong nước.
B. Dung dịch nước của chúng dẫn điện.
C. Có khả năng nhận H+.
D. Có khả năng cho H+.
Lời giải:
Đáp án đúng là: C
Acid là những chất có khả năng cho H+.
Bài 2.7 trang 8 SBT Hóa học 11: Đặc điểm nào sau đây là không đúng khi mô tả về base yếu?
A. Trong dung dịch nước, không phân li hoàn toàn ra OH–.
B. Có khả năng nhận H+.
C. Dung dịch nước của chúng dẫn điện.
D. Có khả năng cho H+.
Lời giải:
Đáp án đúng là: D
Base là những chất có khả năng nhận H+.
H2S(aq) + H2O ⇌ HS–(aq) + H3O+(aq)
A. H2S và H2O. B. H2S và H3O+.
C. H2S và HS–. D. H2O và H3O+.
Lời giải:
Đáp án đúng là: B
Trong phản ứng thuận, H2S đã nhường H+ cho H2O nên đóng vai trò acid.
Trong phản ứng nghịch, H3O+ đã nhường H+ cho HS– nên đóng vai trò là acid.
Lời giải:
Đáp án đúng là: A
Trong phản ứng thuận,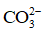
Trong phản ứng nghịch, OH– đã nhận H+ từ 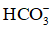
Bài 2.10 trang 8 SBT Hóa học 11: Base liên hợp của các acid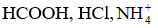
Lời giải:
Đáp án đúng là: A
Phương trình phân li của các chất trên như sau:
Bài 2.11 trang 8 SBT Hóa học 11: Cho phản ứng:
Cặp acid – base liên hợp trong phản ứng trên là:
Lời giải:
Đáp án đúng là: D
Trong phản ứng trên H2SO4 nhường H+ để tạo thành 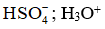
Lời giải:
Lời giải:
Khi hòa tan vào nước, NaOH phân li hoàn toàn thành các ion, còn CH3OH không phân li mà tồn tại chủ yếu ở dạng phân tử.
Lời giải:
a) Cách đơn giản nhất để giảm chứng ợ nóng nhẹ là nuốt nước bọt nhiều lần do nước bọt có chứa ion bicarbonate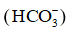
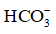
b) Có thể điều trị chứng ợ nóng bằng cách sử dụng các thuốc kháng acid, chẳng hạn “sữa magie” có thành phần chủ yếu là huyền phù Mg(OH)2. Hãy viết phương trình hoá học của phản ứng giữa HCl và Mg(OH)2; giải thích vì sao “sữa magie” hiệu quả hơn nước bọt trong việc trung hoà acid thực quản.
Lời giải:
“Sữa magie” hiệu quả hơn nước bọt trong việc trung hòa acid thực quản do Mg(OH)2 là base mạnh hơn 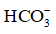
2SO2 + O2 + 2H2O ⟶ 2H2SO4
4NO2 + O2 + 2H2O ⟶ 4HNO3
Các acid này kết hợp với nước mưa tạo thành mưa acid. Hãy viết phương trình điện li của H2SO4 và HNO3 trong nước, biết rằng H2SO4 điện li theo hai nấc, trong đó nấc thứ nhất điện li hoàn toàn tạo thành 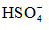
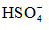
Lời giải:
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 1: Mở đầu về cân bằng hoá học
Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Bài 5: Một số hợp chất quan trọng của nitrogen
Bài 6: Sulfur và sulfur dioxide
Lý thuyết Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
I. Sự điện li, chất điện li và chất không điện li
1. Sự điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion.
2. Chất điện li và chất không điện li
- Chất điện li là những chất khi tan trong nước phân li ra các ion
- Chất điện li là những chất tan trong nước phân li ra các ion. VD: hydrochloric acid, sodium hydroxide, ..
- Chất không điện li là chất không phân li ra các ion. VD: saccarose, ethanol….
II. Thuyết Bronsted – Lowry về acid – base
1. Thuyết Bronsted – Lowry về acid – base
a. Khái niệm acid – base theo thuyết Bronsted – Lowry.
- Acid là chất cho proton (H+).
- Base là chất nhận proton (H+).
b. Ưu điểm của thuyết Bronsted – Lowry.
Tổng quát hơn thuyết Arhenius. (Phân tử không có nhóm –OH như NH3 hay CO3- cũng là base).
2. Acid mạnh / base mạnh và acid yếu / base yếu
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Thường gặp là:
+ Các acid mạnh: HCl, H2SO4, HNO3…
+ Các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2…
+ Hầu hết các muối.
Phản ứng: Một chiều.
Biểu diễn: Mũi tên một chiều (→).
VD: HNO3 → H+ + NO3-.
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần phân tử chất tan phân li ra ion. Thường gặp là:
+ Các acid yếu: CH3COOH, HClO, HF, H2SO3…
+ Base yếu: Cu(OH)2, Fe(OH)2…
Phản ứng: Thuận nghịch.
Biểu diễn: Hai nửa mũi tên ngược nhau (⇆)
VD: CH3COOH ⇆ CH3COO- + H+.