Với giải sách bài tập Hóa học 11 Bài 5: Một số hợp chất quan trọng của nitrogen sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 5: Một số hợp chất quan trọng của nitrogen
|
Cột A |
Cột B |
|
a) Tính chất vật lí |
1. Làm quỳ tím hóa xanh |
|
b) Tính base |
2. Tan trong nước tạo môi trường có pH > 7 |
|
c) Tính khử |
3. Tan vô hạn trong nước |
|
|
4. Phản ứng với acid tạo muối ammonium |
|
|
5. Phản ứng với oxygen |
|
|
6. Phản ứng với một số oxide kim loại tạo ra kim loại và khí nitrogen |
Lời giải:
Đáp án đúng là: a – 3; b – 1, 2, 4; c – 5,6.
Bài 5.2 trang 17 SBT Hoá học 11: Phát biểu nào sau đây là không đúng khi nói về ammonia?
A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn).
B. Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả.
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
Lời giải:
Đáp án đúng là: B.
Ammonia được sử dụng cho sản xuất phân đạm chứa gốc ammonium, urea để dung cấp nguyên tố nitrogen cho đất và cây trồng.
N2(g) + H2(g) 2NH3(g) = −92kJ (1)
Những phát biểu liên quan tới quá trình Haber nào sau đây là đúng?
(a) Là quá trình thuận nghịch nên tại thời điểm cân bằng, hỗn hợp trong buồng phản ứng gồm ammonia, nitrogen và hydrogen.
(b) Do ammonia dễ hoá lỏng hơn nên khi làm lạnh hỗn hợp sẽ tách được ammonia lỏng ra khỏi hỗn hợp khí.
(c) Nếu không sử dụng chất xúc tác thì không thể tạo thành ammonia.
(d) Nếu giảm áp suất của hệ thì phản ứng sẽ chuyển dịch theo chiều thuận.
(e) Phản ứng thuận là phản ứng toả nhiệt. Vì vậy, để phản ứng chuyển dịch theo chiều thuận, cần phải giảm nhiệt độ. Tuy nhiên, nếu giảm nhiệt độ xuống thấp thì tốc độ phản ứng lại nhỏ.
(g) Từ giá trị biến thiên enthalpy chuẩn của phản ứng trên và năng lượng liên kết H−H, N−H lần lượt là 436 kJ mol−1 và 389 kJ mol−1 sẽ xác định được năng lượng liên kết trong phân tử N2 ở cùng điều kiện là 934 kJ mol−1.
Lời giải:
Đáp án đúng là: (a), (b), (e), (g).
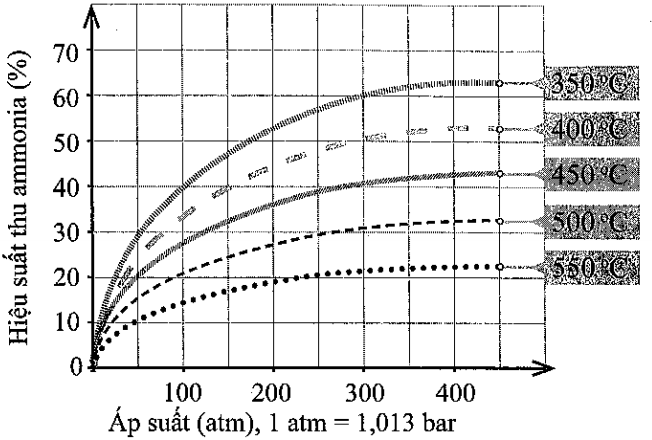
Hình 5. Sự phụ thuộc của hiệu suất tổng hợp ammonia vào áp suất và nhiệt độ phản ứng (Nguồn: Cowbridge Chemistry Department: Making ammonia − The Haber process http://ccschemistry.blogspot.com/2016/, truy cập ngày 22-3-2023.)
Hiệu suất thu ammonia có thể được tính theo công thức:

Khi phản ứng ưu tiên diễn ra theo chiều thuận thì lượng ammonia thu được trong thực tế càng nhiều.
a) Trong khoảng từ 350oC đến 550oC, hiệu suất thu ammonia biến đổi theo xu hướng nào?
b) Vì sao nhiệt độ phản ứng càng cao thì hiệu suất thu ammonia càng thấp?
c) Ở một nhiệt độ, vì sao áp suất tăng cao thì hiệu suất thu ammonia tăng?
d) Từ giản đồ Hình 5, hãy cho biết nên chọn nhiệt độ phản ứng là bao nhiêu để hiệu suất phản ứng đạt khoảng 44% ở 200 atm.
Lời giải:
Đáp án đúng là:
a) Giảm.
b) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, khi nhiệt độ tăng thì cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, tức phản ứng nghịch. Điều đó làm giảm hiệu suất thu ammonia.
c) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, khi áp suất tăng thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức chiều giảm số mol khí, chiều thuận. Điều đó làm tăng hiệu suất thu ammonia.
d) Khoảng 400oC.
Lời giải:
- Quá trình sản xuất NH4Cl, NH4NO3, (NH4)2SO4 theo phản ứng trực tiếp giữa
ammonia và acid tương ứng; đó không phải là các phản ứng oxi hóa – khử.
- Quá trình sản xuất urea theo phản ứng:
2NH3 + CO2 (NH2)2CO + H2O
Đây không phải là phản ứng oxi hoá - khử.
- Các phản ứng trên không tạo khí độc. Tuy nhiên khi sử dụng dư thừa, phân bón chứa các chất này sẽ gây hiện tượng phú dưỡng cho nước và đất.
a) Có hai ống nghiệm cùng dung tích. Mỗi ống nghiệm được đặt vừa khít vào lỗ trống đã được khoét sẵn trên miếng xốp cách nhiệt dày. Cho vào mỗi ống nghiệm 10 mL nước ở cùng nhiệt độ. cắm nhiệt kế thuỷ ngân cùng loại vào mỗi ống nghiệm. Chờ dung dịch ổn định đến nhiệt độ phòng; sau đó, cho 2 gam phân bón urea vào ống nghiệm thứ nhất, 2 gam phân bón ammonium sulfate vào ống nghiệm thứ hai. Nhanh chóng dùng đũa thuỷ tinh khuấy nhẹ để phân bón tan hết. Mức thuỷ ngân trong nhiệt kế ở ống nghiệm nào sẽ thấp hon? Giải thích.
b) Có thể phân biệt nhanh phân bón urea và phân bón ammonium sulfate bằng một lượng nước phù hợp được không? Giải thích.
Lời giải:
a) Mức thuỷ ngân trong ống nghiệm chứa urea sẽ thấp hơn do quá trình hoà
tan urea thu nhiều nhiệt hơn.
b) Có thể phân biệt được dựa vào nhiệt hoà tan.
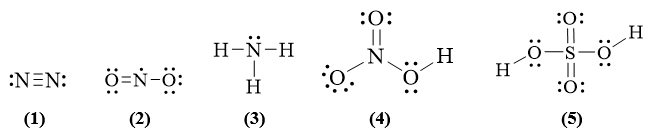
A. 1. B. 2.
C. 3. D. 4.
Lời giải:
Đáp án đúng là: B
Công thức (2) và (5) không thỏa mãn quy tắc octet.
|
b) Có 2 đề xuất về công thức Lewis của phân tử HNO3 như bên: |
|
b1) Công thức (A) hay (B) phù hợp với đặc điểm các electron hoá trị của nguyên tử nitrogen? Theo công thức đó, hoá trị và số oxi hoá của N là bao nhiêu?
b2*) Kết quả nghiên cứu cho biết giá trị độ dài các liên kết giữa nguyên tử N và O (hên kết NO) trong phân tử HNO3 là 1,406 Å; 1,211 Å và 1,199 Å. Công thức (A) hay (B) có thể thoả mãn các số liệu đã cho? Giải thích.
Lời giải:
a) Cấu hình electron của nitrogen theo ô orbital:
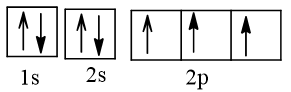
Có 1 cặp electron hoá trị ghép đôi, 3 electron hoá trị độc thân.
b) b1)Công thức (A) phù hợp hơn vì nguyên tử N chỉ có 4 orbital hoá trị, do đó chỉ có thể tạo tối đa 4 liên kết cộng hoá trị. Theo công thức (A), N có hoá trị là IV và số oxi hoá là +5.
b2*) Công thức (A) phù hợp với dữ liệu do có ba loại liên kết giữa N và O không tương đương nhau trong phân tử HNO3 (1 liên kết đôi, 1 liên kết đơn theo kiểu ghép đôi electron hoá trị và 1 liên kết đơn theo kiểu cho - nhận).
Bài 5.9 trang 19 SBT Hoá học 11: Cho hai quá trình sau:
NH4NO3(s) ⟶ N2O(g) + 2H2O(g) = −36 kJ
NH4Cl(s) ⟶ NH3(g) + HCl(g) = 176 kJ
Ammonium nitrate và ammonium chloride được sử dụng làm phân bón. Trong quá trình lưu trữ, dưới ảnh hưởng của nhiệt, phân bón nào có nguy cơ cháy, nổ cao hơn? Giải thích.
Lời giải:
Phân ammonium nitrate có nguy cơ cháy, nổ cao hơn, do phản ứng phân huỷ phát nhiều nhiệt. Ví dụ, vụ nổ ở Beirut, Lebanon (Li-băng) năm 2020 làm hàng trăm người chết, hàng trăm nghìn người mất nhà cửa; nguyên nhân được cho là liên quan đến 2 750 tan ammonium nitrate được cat giữ ở cảng suốt 6 năm một cách không an toàn. Vụ nổ có sức công phá tương đương 1 200 tấn thuốc nổ TNT.
C6H10O + HNO3 ⟶ C6H10O4 + N2O + H2O
a) Cân bằng phương trình hoá học của phản ứng trên theo phương pháp thăng bằng electron.
b) Cho biết vai trò của HNO3 trong phản ứng trên. Giải thích.
Lời giải:
a) 4C6H10O + 6HNO3 ⟶ 4C6H10O4 + 3N2O + 3H2O
b) Do số oxi hoá của N đã giảm từ +5 (trong HNO3) xuống +1 (trong N2O) nên HNO3 đóng vai trò chất oxi hoá.
Au + HNO3 + HCl ⟶ HAuCl4 + H2O + NO
a) Cân bằng phương trình hoá học của phản ứng trên theo phương pháp thăng bằng electron.
b) Cho biết acid nào đóng vai trò chất oxi hoá trong phản ứng trên. Giải thích.
Lời giải:
a) Au + HNO3 + 4HCl ⟶ HAuCl4 + 2H2O + NO
b) Do số oxi hoá của N đã giảm từ +5 (trong HNO3) xuống +2 (trong NO) nên HNO3 đóng vai trò chất oxi hoá.
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 5: Một số hợp chất quan trọng của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 8: Hợp chất hữu cơ và hoá học hữu cơ
Bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
Lý thuyết Một số hợp chất quan trọng của nitrogen
I. Ammonia
1. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo phân tử:
+ Được cấu tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác.
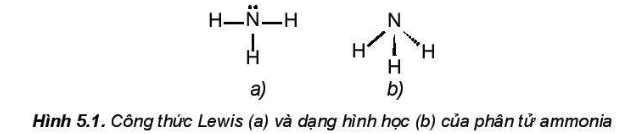
- Tính chất vật lí:
+ Ammonia tồn tại ở cả trong môi trường đất, nước, không khí.
+ Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc, tan nhiều trong nước.
2. Tính chất hóa học
a, Tính base
- Trong dung dịch, nhận proton của nước: NH3 + H2O ⇌ NH4+ + OH-
- Có môi trường base yếu:
+ Làm quỳ tím chuyển màu xanh.
+ Làm phenolphtalein chuyển màu hồng.
- Thể hiện tính chất của một base: NH3 + HCl → NH4Cl
b, Tính khử
4NH4 + 3O2 → 2N2 + 6H2O
4NH3 + 5O2 → 4NO + 6H2O
3. Tổng hợp ammonia theo quá trình Haber
PTHH:
N2 + 3H2 ⇌ 2NH3
( nhiệt độ 400-450oC, áp suất 150-200 bar, xúc tác Fe)
II. Muối ammonium
1. Tính tan, sự điện li
- Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
VD: NH4Cl → NH4+ + Cl-
2. Tác dụng với kiềm – Nhận biết ion ammonuim
- Đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammonia có mùi khai.
VD: NH4Cl + NaOH → NH3 + NaCl + H2O
Phương trình ion rút gọn: NH4+ + OH- → NH3 + H2O.
3. Tính chất kém bền nhiệt
- Các muối ammonuin đều kém bền nhiệt và dễ bị phân hủy khi đun nóng.
VD: NH4Cl → NH3 + HCl
III. Ứng dụng của ammonia và một số muối ammonium
- Ứng dụng của ammonia:
+ Tác nhận làm lạnh.
+ Dung môi.
+ Sản xuất nitric acid.
+ Sản xuất phân đạm.
- Ứng dụng của một số muối ammonium:
+ Chất đánh sạch bề mặt kim loại.
+ Thuốc long đờm.
+ Phân bón hóa học.
+ Chất phụ gia thực phẩm.
+ Thuốc bổ sung chất điện giải.
IV. Nguồn gốc một số oxide của nitrogen trong không khí – mưa acid
1. Nguồn gốc một số oxide của nitrogen
- Bầu khí quyển có oxide của nitrogen NOx.
- NO trong khí quyển được tạo ra khi có sấm sét.
- Hoạt động của con người.
2. Mưa acid
- Nguyên nhân chính: acid nitric và sulfuric acid hòa tan trong nước mưa.
- HÌnh thành:
SO2(g) + O2(g) → SO3(g)
SO3(g) + H2O(l) → H2So4(aq)
V. Nitric acid
Công thức Lewis:
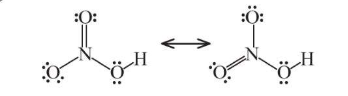
- Nitric acid là chất lỏng, không màu, có tính acid mạnh và tính oxi hóa mạnh
VI. Hiện tượng phú dưỡng
- Khái niệm: Hiện tượng phú dưỡng là sự tích tụ lớn các chất dinh dưỡng, bao gồm cả hợp chất nitrogen và hợp chất phosphorus trong các nguồn nước, do các tác động từ con người.
- Hệ quả: Làm thay đổi hệ sinh thái của nước, tích tụ bùn từ xác của tảo, làm suy kiệt nguồn thủy sản.
- Biện pháp:
+ Tạo điều kiện để nước trong kênh rạch, ao, hồ được lưu thông.
+ Xử lí nước thải trước khi cho chảy vào kênh, rạch, ao, hồ.
+ Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm.