Với lời giải SBT Hóa học 11 trang 11 chi tiết trong Bài 3: pH của dung dịch. Chuẩn độ acid – base Cánh diều giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 3: pH của dung dịch. Chuẩn độ acid – base
Bài 3.4 trang 11 SBT Hóa học 11: Một dung dịch có pH = 11,7. Nồng độ ion hydrogen (H+) của dung dịch là
A. 2,3 M. B. 11,7 M.
C. 5,0.10-3 M. D. 2,0.10-12 M.
Lời giải:
Đáp án đúng là: D
Ta tính được nồng độ H+ theo công thức [H+] = 10–pH.
Bài 3.5 trang 11 SBT Hóa học 11: Giá trị pH của một dung dịch tăng từ 3 lên 5. Những nhận định nào sau đây là sai?
(a) Nồng độ ion H+ của dung dịch giảm 20 lần.
(b) Nồng độ ion OH– của dung dịch khi pH = 5 là 10-9 M.
(c) Nồng độ ion H+ của dung dịch khi pH = 3 là 10-3 M.
(d) Dung dịch ban đầu là một acid có nồng độ 0,001 M.
(e) Dung dịch ban đầu là một base có nồng độ 0,001 M.
Lời giải:
Đáp án đúng là: (a), (e).
Phát biểu (a) sai vì nồng độ ion H+ của dung dịch giảm 100 lần.
Phát biểu (e) sai vì dung dịch ban đầu là một acid có nồng độ 0,001 M.
Bài 3.6 trang 11 SBT Hóa học 11: Calcium hydroxide rắn được hoà tan trong nước cho tới khi pH của dung dịch đạt 10,94. Nồng độ của ion hydroxide (OH–) trong dung dịch là
A. 1,1.10-11 M. B. 3,06 M.
C. 8,7.10-4 M. D. 1,0.10-14 M.
Lời giải:
Đáp án đúng là: C
Ta tính được nồng độ OH– theo công thức [OH–] = 10–pOH (pH + pOH = 14).
Bài 3.7 trang 11 SBT Hóa học 11: Bảng dưới đây là kết quả đo pH của các dung dịch bằng máy đo pH. Xác định tính acid, base hay trung tính và màu của giấy chỉ thị pH khi dùng để thử vào hai cột còn trống trong bảng dưới đây.
Lời giải:
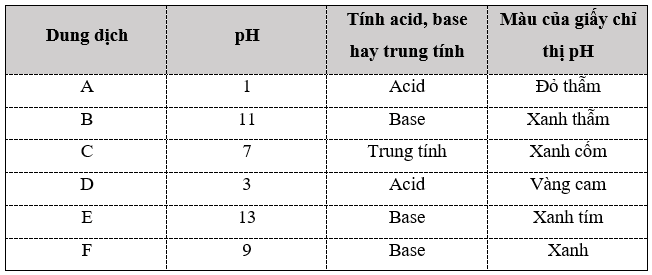
Bài 3.8 trang 11 SBT Hóa học 11: Một dung dịch X thu được bằng cách thêm 50,0 mL dung dịch HBr 0,050 M vào 150,0 mL dung dịch HI 0,100 M. Tính nồng độ H+ và pH của dung dịch X. Biết HBr và HI đều được coi là acid mạnh.
Lời giải:
Số mol H+ trong 50 mL HBr là: 0,05.0,050 = 2,5.10-3 (mol).
Số mol H+ trong 150 mL HI là: 0,15.0,100 = 1,5.10-2 (mol).
Nồng độ H+ của dung địch X là:
[H+] = = 0,0875 (M);
pH = –lg(0,0875) = 1,06.
Bài 3.9 trang 11 SBT Hóa học 11: Xác định pH của dung dịch thu được sau khi thêm 25,0 mL dung dịch NaOH 0,1 M vào 50,0 mL dung dịch HCl 0,1 M.
Lời giải:
Số mol NaOH thêm vào là 2,5.10-3 mol; số mol HCl ban đầu là 5.10-3 mol.
Dựa vào phương trình: H+ + OH– ⟶ H2O, tính được số mol H+ trong dung dịch thu được sau khi thêm NaOH là 2,5.10-3 mol.
Vậy pH = = 1,48.
Bài 3.10 trang 11 SBT Hóa học 11: Ở 25oC, pH của một dung dịch Ba(OH)2 là 10,66. Nồng độ ion hydroxide (OH–) trong dung dịch là bao nhiêu? Để thu được 125 mL dung dịch Ba(OH)2 trên thì khối lượng Ba(OH)2 cần phải hoà tan là bao nhiêu (bỏ qua sự thay đổi thể tích nếu có)?
Lời giải:
Nồng độ OH– là: (M).
Nồng độ của Ba(OH)2 tương ứng là: 2,285.10-4 (M).
Để thu được 125 mL dung dịch Ba(OH)2 thì khối lượng Ba(OH)2 cần hoà tan là:
2,285.10-4.125.10-3.171 = 4,884.10-3 (g).
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 3.1 trang 10 SBT Hóa học 11: Điền thông tin thích hợp vào chỗ trống trong mỗi câu dưới đây...
Bài 3.2 trang 10 SBT Hóa học 11: Những phát biểu nào dưới đây là đúng?...
Bài 3.3 trang 10 SBT Hóa học 11: Nối các đặc điểm ở cột A với chiều thay đổi tính acid, base tương ứng ở cột B cho phù hợp...
Bài 3.4 trang 11 SBT Hóa học 11: Một dung dịch có pH = 11,7. Nồng độ ion hydrogen (H+) của dung dịch là...
Bài 3.5 trang 11 SBT Hóa học 11: Giá trị pH của một dung dịch tăng từ 3 lên 5. Những nhận định nào sau đây là sai?...
Bài 3.6 trang 11 SBT Hóa học 11: Calcium hydroxide rắn được hoà tan trong nước cho tới khi pH của dung dịch đạt 10,94. Nồng độ của ion hydroxide (OH–) trong dung dịch là...
Bài 3.7 trang 11 SBT Hóa học 11: Bảng dưới đây là kết quả đo pH của các dung dịch bằng máy đo pH. Xác định tính acid, base hay trung tính và màu của giấy chỉ thị pH khi dùng để thử vào hai cột còn trống trong bảng dưới đây...
Bài 3.8 trang 11 SBT Hóa học 11: Một dung dịch X thu được bằng cách thêm 50,0 mL dung dịch HBr 0,050 M vào 150,0 mL dung dịch HI 0,100 M. Tính nồng độ H+ và pH của dung dịch X. Biết HBr và HI đều được coi là acid mạnh...
Bài 3.9 trang 11 SBT Hóa học 11: Xác định pH của dung dịch thu được sau khi thêm 25,0 mL dung dịch NaOH 0,1 M vào 50,0 mL dung dịch HCl 0,1 M...
Bài 3.10 trang 11 SBT Hóa học 11: Ở 25oC, pH của một dung dịch Ba(OH)2 là 10,66. Nồng độ ion hydroxide (OH–) trong dung dịch là bao nhiêu? Để thu được 125 mL dung dịch Ba(OH)2 trên thì khối lượng Ba(OH)2 cần phải hoà tan là bao nhiêu (bỏ qua sự thay đổi thể tích nếu có)?...
Bài 3.11 trang 12 SBT Hóa học 11: Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanoic acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH, phát biểu nào sau đây là đúng?...
Bài 3.12 trang 12 SBT Hóa học 11: a) Cốc A chứa 50 mL dung dịch KOH 0,10 M được chuẩn độ với dung dịch HNO3 0,10 M. Sau khi thêm 52 mL dung dịch HNO3 vào, pH của dung dịch trong cốc A là...
Bài 3.13 trang 12 SBT Hóa học 11: Một mẫu dung dịch H2SO4 (gọi là mẫu A) được phân tích bằng cách thêm 50,0 mL dung dịch NaOH 0,213 M vào 100 mL dung dịch mẫu A rồi lắc đều. Sau khi phản ứng xảy ra, người ta thấy trong hỗn hợp dung dịch còn dư ion OH–. Phần ion dư này cần 13,21 mL HCl 0,103 M để trung hoà. Tính nồng độ mol L–1 của mẫu A...
Bài 3.14 trang 12 SBT Hóa học 11: a) Lan thực hiện phép chuẩn độ 50,00 mL dung dịch acid nồng độ 0,10 M bằng dung dịch NaOH cùng nồng độ (0,10 M), Lan rất ngạc nhiên khi thấy phải cần 100 mL dung dịch NaOH để đạt tới điểm tương đương. Em hãy giải thích thắc mắc cho Lan...
Bài 3.15 trang 13 SBT Hóa học 11: a) 10 mL dung dịch sulfuric acid 5.10-3 M được cho vào một bình định mức dung tích 100 mL...
Bài 3.16 trang 13 SBT Hóa học 11: Nồng độ carbon dioxide (CO2) trong khí quyển đã tăng khoảng 20% trong thế kỉ qua. Giả sử các đại dương của Trái Đất tiếp xúc với khí CO2 trong khí quyển, lượng CO2 tăng lên có thể có ảnh hưởng gì đến pH của các đại dương trên thế giới? Sự thay đổi này có thể ảnh hưởng gì đến cấu trúc đá vôi (chủ yếu là CaCO3) của các rạn san hô và vỏ sò biển?...
Bài 3.17 trang 13 SBT Hóa học 11: Oxygen được dẫn truyền trong cơ thể là do khả năng liên kết của oxygen với hồng cầu trong máu theo cân bằng sau:...
Bài 3.18 trang 13 SBT Hóa học 11: Acetic acid (CH3COOH) là một acid yếu...
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác: