Với giải Luyện tập 1 trang 45 Hóa học lớp 11 Cánh diều chi tiết trong Bài 7: Sulfuric acid và muối sulfate giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 7: Sulfuric acid và muối sulfate
Luyện tập 1 trang 45 Hoá học 11: Hãy viết phương trình hoá học của phản ứng giữa dung dịch sulfuric acid loãng, dư với lần lượt từng chất sau: kẽm (zinc), zinc oxide, barium hydroxide, sodium carbonate.
Lời giải:
Các phương trình hoá học xảy ra:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g);
ZnO(s) + H2SO4(aq) → ZnSO4(aq) + H2O(l);
Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + 2H2O(l);
Na2CO3(aq) + H2SO4(aq) → Na2SO4(aq) + CO2(g) + H2O(l).
Lý thuyết Sulfuric acid
1. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo phân tử:
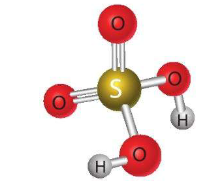
- Tính chất vật lí:
+ Là chất lỏng sánh như dầu, không màu, không bay hơi.
+ Dung dịch sulfuric acid đặc có khả năng hút ẩm.
2. Tính chất hóa học
a, Tính chất hóa học của dung dịch sulfuric acid loãng
+ Đổi màu quý tím thành đỏ
+ Tác dụng với kim loại hoạt động.
+ Tác dụng với basic oxide và base.
+ Tác dụng với nhiều muối.
b, Tính chất hóa học của dung dịch sulfuric acid đặc
- Tính oxi hóa mạnh
+ Oxi hóa hầu hết các kim loại (trừ vàng, platinium), nhiều phi kim như carbon, sulfur, phosphorus… và nhiều hợp chất
VD: H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
- Tính háo nước
+ Dung dịch sulfuric acid đặc hấp thụ mạnh nước.
3. Bảo quản và xử lí bỏng sulfuric acid
- Bảo quản: Chai, lọ đựng sulfuric acid phải để ở nơi ít có nguy cơ bị va chạm, xa nguồn nhiệt và các hóa chất khác.
- Xử lí bỏng sulfuric acid: Sơ cứu người bị bỏng bằng cách rửa vết bỏng dưới vòi nước sạch ít nhất 20 phút trước khi đưa đến cơ sở y tế.
+ Tuyệt đối không chườm đá lạnh, khong xoa vết bỏng bằng các loại kem, gel, dầu …
4. Ứng dụng và sản xuất sulfuric acid
a, Ứng dụng
- Sản xuất phân bón.
- Chất tẩy rửa, phẩm màu, thuốc trừ sâu…
b, Sản xuất sulfuric acid bằng phương pháp tiếp xúc
S(s) + O2(g) → SO2(g)
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
2SO2 + O2(g) → 2SO3
H2SO4(aq) + nSO3(g) → H2SO4.nSO3(l)
H2SO4.nSO3 (l) + nH2O → (n+1) H2SO4
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Mở đầu trang 44 Hoá học 11: Nhãn dán trên chai đựng dung dịch sulfuric acid thường có hình như Hình 7.1. Giải thích ý nghĩa của hình và nguyên nhân gây nên hiện tượng được mô tả trong hình......
Câu hỏi 1 trang 44 Hoá học 11: Hãy viết công thức Lewis của phân tử H2SO4.....
Thí nghiệm 1 trang 45 Hoá học 11: Tính oxi hoá của dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc...
Thí nghiệm 2 trang 45 Hoá học 11: Tính háo nước và tính oxi hoá của dung dịch sulfuric acid đặc....
Luyện tập 1 trang 45 Hoá học 11: Hãy viết phương trình hoá học của phản ứng giữa dung dịch sulfuric acid loãng, dư với lần lượt từng chất sau: kẽm (zinc), zinc oxide, barium hydroxide, sodium carbonate.....
Câu hỏi 2 trang 46 Hoá học 11: Số oxi hoá lớn nhất của sulfur trong các hợp chất là +6. Vậy H2SO4 có khả năng thể hiện tính khử không? Giải thích.....
Luyện tập 2 trang 46 Hoá học 11: Dự đoán hiện tượng xảy ra khi cho vài giọt dung dịch sulfuric acid đặc vào ống nghiệm chứa vài hạt cơm (thành phần chính là tinh bột ((C6H10O5)n). Viết phương trình hoá học minh hoạ.....
Luyện tập 3 trang 47 Hoá học 11: Phòng thí nghiệm có một lọ đựng dung dịch sulfuric acid đặc không còn nguyên chất, không sử dụng được nữa. Hãy đề xuất cách loại bỏ lọ acid này một cách an toàn mà ít gây ảnh hưởng đến môi trường và sức khoẻ....
Câu hỏi 3 trang 48 Hoá học 11: “Nhờ có chất xúc tác nên phản ứng giữa SO2 và O2 ưu tiên chuyển dịch theo chiều thuận”. Phát biểu trên là đúng hay sai? Giải thích.....
Vận dụng trang 48 Hoá học 11: Quá trình sản xuất sulfuric acid có thể ảnh hưởng đến môi trường và người tham gia sản xuất. Hãy tìm hiểu nguyên nhân và đề xuất một số biện pháp hạn chế những tác hại đó.....
Câu hỏi 4 trang 49 Hoá học 11: Hai chất phụ gia thực phẩm đều màu trắng là bột thạch cao nung và bột “baking soda” NaHCO3. Làm thế nào để phân biệt hai chất phụ gia này?....
Luyện tập 4 trang 50 Hoá học 11: Trình bày cách sử dụng dung dịch barium hydroxide để phân biệt ba phân đạm có thành phần chính lần lượt là NaNO3, NH4Cl, (NH4)2SO4.....
Bài 1 trang 50 Hoá học 11: a) Tính thể tích dung dịch H2SO4 98% (D = 1,84 g mL-1) cần dùng để pha chế thành 500 mL dung dịch H2SO4 0,05 M.....
Bài 2 trang 50 Hoá học 11: Các ao, hồ, suối, sông quanh miệng núi lửa thường có môi trường acid. Điển hình là hồ Kawah Ijen, miền Đông đảo Java, Indonesia. Hồ nằm cao hơn mặt nước biển 2 300 m, được cho là “hồ acid” lớn nhất thế giới. Giá trị pH của nước trong hồ dao động từ 0,13 đến 0,50 chủ yếu do sulfuric acid gây nên.....
Bài 3 trang 50 Hoá học 11: Dựa vào tính chất nào để phân biệt nhanh muối magnesium sulfate và muối barium sulfate?....
Bài 4 trang 50 Hoá học 11: Viết phương trình hoá học của các phản ứng theo dãy chuyển hoá dưới đây.....
Xem thêm các bài giải SGK Hóa học lớp 11 Cánh diều hay, chi tiết khác:
