Tailieumoi.vn xin giới thiệu đến các quý Thầy/Cô Giáo án điện tử Hóa học lớp 11 Cánh diều theo mẫu Giáo án POWERPOINT chuẩn của Bộ GD&ĐT. Hi vọng tài liệu này sẽ giúp Giáo viên dễ dàng biên soạn giáo án PPT Hóa học 11.
Chỉ từ 400k mua trọn bộ Giáo án Hóa học 11 Cánh diều bản POWERPOINT trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 30k cho 1 bài Giáo án lẻ bất kì):
B1: Gửi phí vào tài khoản0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây
Xem thử tài liệu tại đây: Link tài liệu
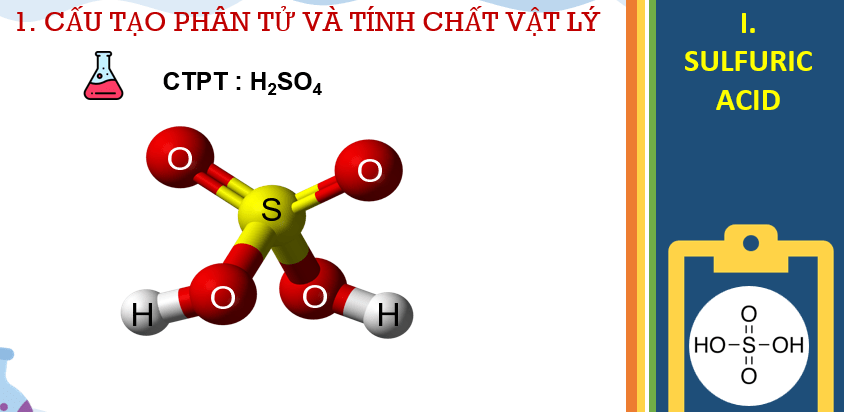
Bài giảng điện tử Hóa 11 Bài 7: Sulfuric acid và muối sulfate







................................................
................................................
................................................
Tài liệu có 46 trang, trên đây trình bày tóm tắt 10 trang của Giáo án POWERPOINT Hóa 11 Cánh diều Bài 7: Sulfuric acid và muối sulfate.
Giáo án Bài 7: Sulfuric acid và muối sulfate
I. Mục tiêu
1. Kiến thức
- Tính chất vật lí của H2SO4, cách bảo quản, sử dụng và nguyên tắc xử lý sơ bộ khi bỏng acid.
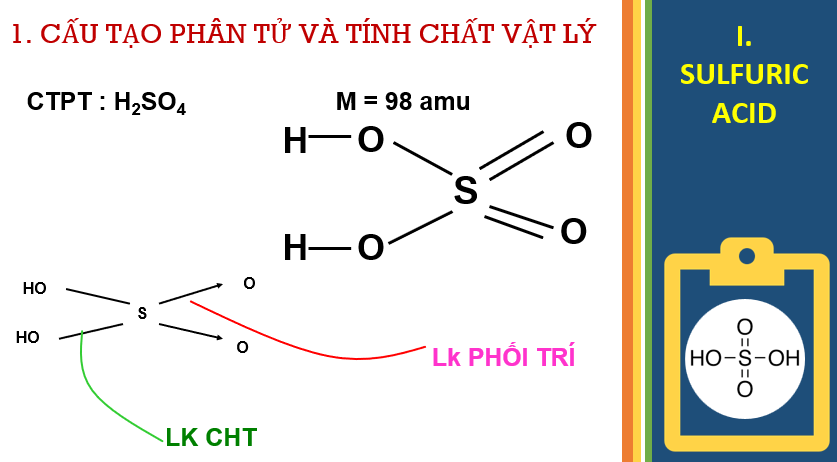
- Cấu tạo phân tử H2SO4, tính chất vật lý, tính chất hóa học cơ bản, ứng dụng của dung dịch sulfuric acid loãng, dung dịch sulfuric acid đặc và những lưu ý khi sử dụng acid.
- Giải thích được tính chất hoá học của acid H2SO4 loãng và đặc (tính acid và tính oxi hóa mạnh).
- Nêu được ứng dụng của một số muối sulfate quan trọng: barium sulfate, ammonium sulfate, calcium sulfate, magnesium sulfate...
2. Năng lực
2.1. Năng lực chung:
- Năng lực hợp tác: Biết chủ động đề xuất mục đích hợp tác để nhiệm vụ do bản thân và những người khác đề xuất.
2.2. Năng lực hóa học:
a. Nhận thức hoá học:
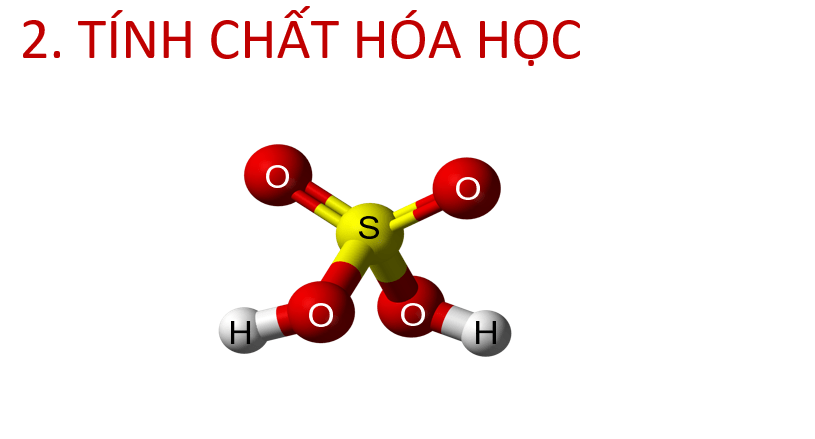
- Dự đoán, kiểm tra, kết luận được về tính chất hoá học của H2SO4.
- Thực hiện một số phản ứng chứng minh tính chất hóa học của sulfuric acid với kim loại, base, muối.
- Quan sát thí nghiệm, hình ảnh... rút ra được nhận xét về tính chất, điều chế sulfuric acid.
- Viết phương trình hóa học minh họa tính chất hóa học của acid H2SO4 loãng và đặc.
- Ứng dụng của một số muối sulfate quan trọng
- Giải một số bài tập tổng hợp có nội dung liên quan.
- Nhận biết được ion sulfate bằng ion Ba2+.
b. Tìm hiểu tự nhiên dưới góc độ hóa học được thực hiện thông qua các hoạt động:
Thông qua các hoạt động thảo luận, quan sát thực tiễn, tiến hành thí nghiệm, tìm hiểu thông tin.. để tìm hiểu các yêu cầu về mục tiêu nhận thức kiến thức ở trên.
c. Vận dụng kiến thức, kĩ năng đã học để giải thích được hiện tượng thực tiễn: ô nhiễm môi trường, mưa acid…
3. Phẩm chất
- Chăm chỉ: tích cực tìm tòi, sáng tạo khi tham gia thảo luận nhóm, nghiên cứu tài liệu hoàn thành phiếu học tập trong quá trình học tập.
- Trách nhiệm: thực hiện các nhiệm vụ học tập của cá nhân, chịu trách nhiệm về quá trình thực hiện nhiệm vụ học tập của mình.
II. Thiết bị dạy học và học liệu
1. Giáo viên
- Phiếu bài tập số 1, số 2, số 3
- Video, hình ảnh, học liệu….
- Giấy A0, giấy A4,…
- Dụng cụ thí nghiệm và hóa chất:
+ Dụng cụ: Ống nghiệm; giá để ống nghiệm; ống nhỏ giọt, đèn cồn, cốc thủy tinh, kep gỗ, chậu thủy tinh, bông gòn, nút ống nhiệm
+ Hóa chất: H2SO4 đặc, H2SO4 loãng, Zn, Cu, CuO, đường kính, quỳ tím, Na2CO3, BaCl2, phenolphthalein, NaOH, cánh hoa hồng,…
2. Học sinh
- SGK, SBT, vở ghi.
- Ôn tập bài cũ và chuẩn bị bài mới.
III. Tiến trình dạy học
1. Hoạt động 1: Khởi động
a) Mục tiêu: Kích thích hứng thú, tạo tư thế sẵn sàng học tập và tiếp cận nội dung bài học.
b) Nội dung: Dẫn dắt vào nội dung bài học.
- GV đưa ra 5 câu hỏi cho HS sử dụng quizizz để tham gia ôn tập kiến thức bài 7: Sulfur và sulfur dioxide.
PHIẾU BÀI TẬP TRÊN QUIZIZZ
Câu 1: Hình ảnh sau đây là cấu tạo phân tử của nguyên tố nào?
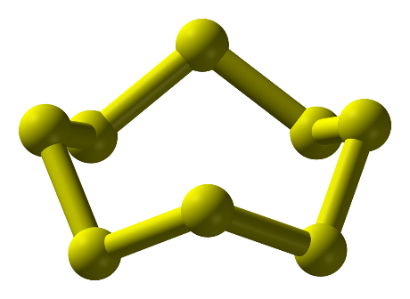
A. Nguyên tố oxygen.
B. Nguyên tố chlorine.
C. Nguyên tố nitrogen.
D. Nguyên tố sulfur.
Câu 2: Ở điều kiện thường, đơn chất sulfur có trạng thái và màu sắc như thế nào?
A. Chất lỏng, màu vàng.
B. Chất rắn, màu nâu đỏ.
C. Chất rắn, màu vàng.
D. Chất lỏng, màu nâu đỏ.
Câu 3: Nguyên tố sulfur thể hiện tính chất hóa học nào sau đây trong phản ứng dùng sulfur để loại bỏ thủy ngân rơi vãi khi nhiệt kế thủy ngân bị vỡ.
A. Tính khử.
B. Tính oxi hóa.
C. Vừa thể hiện tính oxi hóa, vừa thể hiện tính khử.
D. Tính acid.
Câu 4: Trong hợp chất nguyên tử Sulfur thể hiện nhiều số oxi hóa khác nhau như:
A. +2, +4, +6. B. -2, +2, +4, +6.
C. -1, -2, +4, +6. D. -2, +4, +6.
Câu 5: Sulfur dioxide là chất khí không màu, có mùi hắc, độc,…Được biết khí sulfur dioxide có nhiều tác hại trong môi trường sống và sức khỏe con người. Dưới đây đâu không phải là biện pháp nhằm giảm lượng khí sulfur dioxide thải vào bầu khí quyển:
A. Thay thế dần các nhiên liệu hóa thạch bằng nhiên liệu thân thiện môi trường kết hợp với khai thác các nguồn năng lượng tái tạo
B. Xử lý khí thải của các nhà máy trước khi thải khí ra môi trường
C. Sử dụng phương pháp đốt cháy sulfur trong không khí là phương pháp chính để điều chế sulfur dioxide
D. Chuyển hóa sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hóa chất như vôi sống, vôi tôi hoặc đá vôi nghiền
c) Sản phẩm: đáp án 5 câu hỏi ôn tập kiến thức bài 7: Sulfur và sulfur dioxide như in đậm.
d) Tổ chức thực hiện:
Giao nhiệm vụ học tập:
- GV hướng dẫn HS đăng nhập bằng cách vào ứng dụng hoặc truy cập trang web quizizz thông qua điện thoại. Nhập mã hoặc quét QR để vào tham gia. Yêu cầu HS nhập tên.
Thực hiện nhiệm vụ học tập:
- HS sẽ thực hiện 5 câu hỏi trên quizizz một cách độc lập. Quizizz sẽ đưa ra danh sách bạn điểm cao và nhanh nhất được GV công bố bằng ứng dụng cho cả lớp cùng xem.
Báo cáo, thảo luận:
- GV sẽ cùng sửa đáp án 5 câu hỏi đồng thời ôn tập nội dung kiến thức bài 7: Sulfur và sulfur dioxide
Kết luận, nhận định:
- GV nhận xét vầ kết quả tham gia trò chơi của lớp. Tuyên dương và cộng điểm cột thường xuyên cho 3 bạn cao điểm nhất.
- GV dẫn dắt vào bài mới: Nếu như ở tiết học trước chúng ta đã tìm hiểu sulfur đơn chất và hơp chất của nguyên tố sulfur là sulfur dioxide. Thì tiết học ngày hôm nay cô và các em sẽ tiếp tục tìm hiểu những hợp chất sulfur có vai trò quan trọng trong đời sống của con người chúng ta đó chính là Sulfuric acid và muối sulfate thông qua bài 7 Sulfuric acid và muối sulfate.
2. Hoạt động 2: Hình thành kiến thức mới
................................................
................................................
................................................
Xem thêm các bài giảng điện tử Hóa 11 Cánh diều hay, chi tiết khác:
Để mua Giáo án PPT Hóa học 11 Cánh diều năm 2024 mới nhất, mời Thầy/Cô liên hệ Mua tài liệu hay, chọn lọc