Với lời giải SBT Hóa học 11 trang 14 chi tiết trong Bài 3: Ôn tập chương 1 sách Kết nối tri thức giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 3: Ôn tập chương 1
Lời giải:
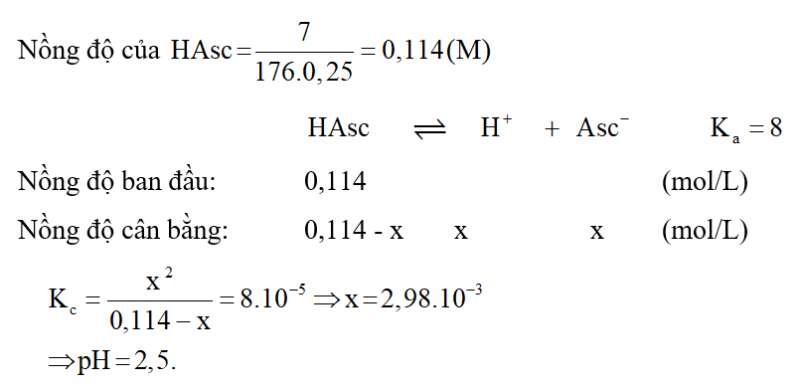
Ở 50oC, giá trị Kc của phản ứng trên là 7,5. Nếu cho 23,0 gam ethanol phản ứng với 37,0 g propanoic acid ở 50OC thì khối lượng của ethyl propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu? (Coi tồng thể tích của hệ phản ứng không đổi).
Lời giải:

Bài 3.13 trang 14 SBT Hóa 11: Cho cân bằng hoá học sau:
Cho 3,0 mol khí hydrogen và 1,0 mol khí nitrogen vào một bình kín dung tích 10 lít, có bột iron xúc tác, giữ bình ở 450oC. Ở trạng thái cân bằng có 20% chất đầu chuyền hoá thành sản phẩm.
a) Xác định số mol các chất ở trạng thái cân bằng.
b) Tính hằng số cân bằng của phản ứng ở nhiệt độ trên.
c) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nào?
Lời giải:
a)
Ban đầu: 1,0 3,0 (mol)
Phản ứng: 0,2 0,6 0,4 (mol)
Cân bằng: 0,8 2,4 0,4 (mol)
Nồng độ: 0,08 0,24 0,04 (mol)
b)
c) Nếu tăng nhiệt độ của bình phản ứng: cân bằng chuyển dịch theo chiều thu nhiệt tức là theo chiều nghịch, Kc giảm.
b) Trong dung dịch nước ion CH3COO- nhận proton của nước. Viết phương trình thuỷ phân và cho biết môi trường của dung dịch CH3COONa.
c) Cho 10 mL dung dịch NaOH 0,1 M vào 10 mL dung dịch CH3COOH 0,2 M thu được 20 mL dung dịch A. Tính pH của dung dịch A.
Lời giải:
a) Phương trình phân li xảy ra như sau:
b)
Phương trình thủy phân của ion CH3COO-:
CH3COO- + H2O ⇌ CH3COOH + OH-
Dung dịch CH3COONa có môi trường base.
c) Phản ứng :
Ban đầu: 2.10-3 1.10-3 (mol)
Phản ứng: 1.10-3 0 1.10-3 (mol)
Sau phản ứng: 1.10-3 1.10-3 (mol)
Nồng độ: 0,05 0,05 (mol/L)
Xét cân bằng hóa học sau:
Ban đầu: 0,05 0,05 0 (mol/L)
Cân bằng: 0,05 - x 0,05 + x x (mol/L)
.
Bài 3.15 trang 14 SBT Hóa 11: Một học sinh cân 1,062 g NaOH rắn rồi pha thành 250 mL dung dịch A.
a) Tính nồng độ CM của dung dịch A.
b) Lấy 5,0 mL dung dịch A rồi chuẩn độ với dung dịch HCl 0,1 M thì thấy hết 5,2 mL. Tính nồng độ dung dịch A từ kết quả chuẩn độ trên.
c) Nêu một số nguyên nhân dẫn đến việc sai khác nồng độ dung dịch A trong câu a và b.
Lời giải:
Số mol NaOH = 0,02655 mol.
a) CM của dung dịch A = 0,1062 M
b) Phản ứng chuẩn độ: HCl + NaOH → NaCl + H2O
Nồng độ dung dịch NaOH =
c) Một số nguyên nhân dẫn đến việc sai khác nồng độ dung dịch A: NaOH hút ẩm trong không khí, hấp thụ một lượng nhỏ khí CO2 trong không khí.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 3.1 trang 12 SBT Hóa 11: Cho phản ứng hoá học sau:...
Bài 3.2 trang 12 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 3.3 trang 12 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 3.4 trang 13 SBT Hóa 11: Cho cân bằng hoá học sau: ...
Bài 3.7 trang 13 SBT Hóa 11: Cho phản ứng thuận nghịch sau: ...
Bài 3.13 trang 14 SBT Hóa 11: Cho cân bằng hoá học sau: ...
Bài 3.15 trang 14 SBT Hóa 11: Một học sinh cân 1,062 g NaOH rắn rồi pha thành 250 mL dung dịch A...
Xem thêm các bài giải SBT Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 2: Cân bằng trong dung dịch nước