Với giải Bài 3.5 trang 13 SBT Hóa Học lớp 11 Kết nối tri thức chi tiết trong Bài 3: Ôn tập chương 1 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa Học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 3: Ôn tập chương 1
Bài 3.5 trang 13 SBT Hóa 11: Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thuỷ phân, còn cation kim loại trung bình và yếu bị thuỷ phân tạo môi trường acid, gốc acid yếu bị thuỷ phân tạo môi trường base. Dung dịch muối nào sau đây có pH < 7 ?
A. FeCl3.
B. KCl.
C. Na2CO3.
D. Na2SO4.
Lời giải:
Đáp án đúng là: A
pH < 7 ứng với môi trường acid, muối FeCl3 là muối chứa cation kim loại trung bình.
Cân bằng trong dung dịch nước
|
Sự điện li - Quá trình phân li các chất trong nước tạo thành ion. - Chất điện li mạnh: acid mạnh, base mạnh, hầu hết các muối. - Chất điện li yếu: acid yếu, base yếu. - Chất không điện li: nước, saccharose, ethanol,… |
Thuyết acid – base của Bronsted – Lowry - Acid là chất cho proton. - Base là chất nhận proton. |
|
pH = -log[H+] hoặc [H+] = 10-pH 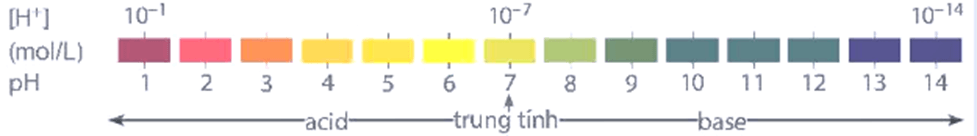 |
|
|
Trong dung dịch nước, một số ion như Al3+, Fe3+ và phản ứng với nước tạo ra các dung dịch có môi trường acid/base. |
|
Xem thêm lời giải Sách bài tập Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 3.1 trang 12 SBT Hóa 11: Cho phản ứng hoá học sau:...
Bài 3.2 trang 12 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 3.3 trang 12 SBT Hóa 11: Cho phản ứng hoá học sau: ...
Bài 3.4 trang 13 SBT Hóa 11: Cho cân bằng hoá học sau: ...
Bài 3.7 trang 13 SBT Hóa 11: Cho phản ứng thuận nghịch sau: ...
Bài 3.13 trang 14 SBT Hóa 11: Cho cân bằng hoá học sau: ...
Bài 3.15 trang 14 SBT Hóa 11: Một học sinh cân 1,062 g NaOH rắn rồi pha thành 250 mL dung dịch A...
Xem thêm các bài giải SBT Hóa học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 2: Cân bằng trong dung dịch nước