Với giải sách bài tập Hoá học 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 12.1 trang 44 SBT Hóa học 10. Số oxi hóa của nguyên tử S trong hợp chất SO2 là:
A. + 2.
B. + 4.
C. + 6.
D. – 1.
Lời giải:
Đáp án đúng là: B
Số oxi hóa của O là -2, gọi số oxi hóa của S là x ta có: x.1 + (-2).2 = 0 ⇒ x = +4.
A. Số mol
B. Số oxi hóa
C. Số khối
D. Số proton
Lời giải:
Đáp án đúng là: B
Dấu hiệu để nhận ra phản ứng là phản ứng oxi hóa – khử dựa trên sự thay đổi số oxi hóa.
Thông tin trả lời câu hỏi 12.3. và 12.4.
Calcium chloride dùng trong điện phân để sản xuất calcium kim loại và điều chế các hợp kim của calcium. Với tính chất hút ẩm lớn, calcium chloride được dùng làm tác nhân sấy khí và chất lỏng. Do nhiệt độ đông đặc thấp nên dung dịch calcium(II) chloride được dùng làm chất tải lạnh trong các hệ thống lạnh, … Ngoài ra, calcium chloride còn được làm chất keo tụ trong hóa dược và dược phẩm hay trong công việc khoan dầu khí.

Dựa vào thông tin trên, hãy trả lời các câu hỏi 12.3. và 12.4.
Bài 12.3 trang 44 SBT Hóa học 10. Trong phản ứng tạo thành calcium(II) chloride từ đơn chất: .
A. Mỗi nguyên tử calcium nhận 2e.
B. Mỗi nguyên tử chlorine nhận 2e.
C. Mỗi phân tử chlorine nhường 2e.
D. Mỗi nguyên tử calcium nhường 2e.
Lời giải:
Đáp án đúng là: D
Trong phản ứng tạo thành calcium(II) chloride từ đơn chất: mỗi nguyên tử calcium nhường 2 electron; mỗi nguyên tử chlorine nhận 1 electron; mỗi phân tử chlorine nhận 2 electron.
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: B
Bài 12.5 trang 45 SBT Hóa học 10. Cho các phản ứng sau:
A. 2
B. 3
C. 5
D. 4
Đáp án đúng là: C
Cả 5 phản ứng trên đều là phản ứng oxi hóa khử vì các phản ứng đều có sự thay đổi số oxi hóa của một số nguyên tố.
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: B
Phản ứng không là phản ứng oxi hóa – khử, nên trong phản ứng này NH3 không thể hiện tính khử.
A. 8
B. 6
C. 4
D. 2
Lời giải:
Đáp án đúng là: D
Dựa vào phương trình hóa học ta thấy, cứ 8 phân tử HNO3 thì có 6 phân tử đóng vai trò là môi trường tạo muối; 2 phân tử đóng vai trò là chất oxi hóa.
Thông tin trả lời câu 12.8 đến 12.10
Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hóa khác nhau từ + 2 tới + 7.

Dựa vào thông tin trên, hãy trả lời các câu hỏi 12.8 đến 12.10
A. 2; - 2; - 4; + 8
B. 0; + 4; + 2; + 7
C. 0; + 4; - 2; + 7
D. 0; + 2; - 4; - 7
Lời giải:
Đáp án đúng là: B
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: C
A. SO2 đã oxi hóa KMnO4 thành MnO2.
B. SO2 đã khử KMnO4 thành Mn2+
C. KMnO4 đã khử SO2 thành ![]()
D. H2O đã oxi hóa KMnO4 thành Mn2+
Lời giải:
Đáp án đúng là: B
Sục khí SO2 vào dung dịch KMnO4 (thuốc tím), màu tím nhạt dần rồi mất màu do SO2 đã khử KMnO4 thành Mn2+
Bài 12.11 trang 46 SBT Hóa học 10. Xác định số oxi hóa của các nguyên tố trong các chất và ion sau:
a)
b)
c)
d)
e.
Lời giải:
Áp dụng các quy tắc:
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0.
Ví dụ:
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0.
Ví dụ: Xác định số oxi hóa các nguyên tố trong SO3:
Trong SO3, số oxi hóa của O là -2; gọi số oxi hóa của S là x, ta có:
x × 1 + 3 × (-2) = 0 ⇒ x = +6.
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với các ion đa nguyên tử) bằng điện tích của ion đó.
Ví dụ: Số oxi hóa của nguyên tử Br trong ion Br- là -1.
- Quy tắc 4: Trong đa số các hợp chất, số oxi hóa của hydrogen là +1, trừ các hydride kim loại như NaH, CaH2 …. Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide; superoxide (như H2O2; Na2O2; KO2 …). Kim loại kiềm (nhóm IA) luôn có số oxi hóa + 1; kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm có số oxi hóa +3. Số oxi hóa của các nguyên tử nguyên tố fluorine trong các hợp chất bằng -1.
Từ đó ta có kết quả sau:
a)
b)
c)
d)
e.
a)
b)
Lời giải:
a)
b)
Bài 12.13 trang 46 SBT Hóa học 10. Phản ứng nào sau đây là phản ứng oxi hóa – khử? Giải thích.
Lời giải:
Những phản ứng (c), (e) và (g) là phản ứng oxi hoá – khử do có sự thay đổi số oxi hoá của một số nguyên tố trong phản ứng
c)
e)
g)

Một số phản ứng xảy ra trong quá trình gỉ sắt:
a) Phản ứng nào ở trên là phản ứng oxi hóa – khử?
b) Xác định sự thay đổi số oxi hóa của các nguyên tố, nêu rõ chất oxi hóa, chất khử.
c) Cân bằng phản ứng trên bằng phương pháp thăng bằng electron.
Lời giải:
a) Phản ứng (1), (2) và (4) là phản ứng oxi hoá – khử.
b)
- Phản ứng (1):
Chất khử: Fe; chất oxi hóa: O2.
- Phản ứng (2):
Chất khử: Fe; chất oxi hóa: O2.
- Phản ứng (4):
Chất khử: Fe; chất oxi hóa: O2.
c) Cân bằng phản ứng:
- Phản ứng (1):
- Phản ứng (2):
- Phản ứng (4):
Phản ứng thủy phân và phản ứng lên men:

a) Phản ứng nào ở trên là phản ứng oxi hóa – khử? Giải thích.
b) Trong phản ứng oxi hóa – khử, em hãy xác định số oxi hóa của các nguyên tố, nêu rõ chất oxi hóa, chất khử.
c) Cân bằng phản ứng oxi hóa – khử trên bằng phương pháp thăng bằng electron.
Phản ứng thuỷ phân và phản ứng lên men.
(1)
(2)
a) Phản ứng (2) là phản ứng oxi hoá – khử do có sự thay đổi số oxi hoá của nguyên tố C.
b) Cân bằng phản ứng oxi hóa – khử (phản ứng (2) bằng phương pháp thăng bằng electron:
C6H12O6 vừa là chất oxi hóa, vừa là chất khử.
c) Cân bằng phản ứng oxi hóa – khử:
Lời giải:
a)
- Chất khử: H2S; chất oxi hóa: SO2.
Phương trình hóa học:
2H2S + SO2 → 3S + 2H2O
b)
Phương trình hóa học:
c)
- Chất khử: FeS2; chất oxi hóa: O2
Phương trình hóa học:
d)
- Chất khử: C12H22O11; chất oxi hóa: H2SO4.
Phương trình hóa học:
a) Tính số gam iodine (I2) tạo thành.
b) Tính khối lượng potassium iodide (KI) đã tham gia phản ứng.
Lời giải:
a) Ta có số mol manganese(II) sulfate = 0,02 mol
Khối lượng iodine tạo thành: 0,05. 254 = 12,7 g.
b) Khối lượng potassium iodide đã tham gia phản ứng: 0,1.166 = 16,6 g.
Lời giải:
Lập phương trình hóa học của phản ứng:
Phương trình hóa học:
Theo phương trình hóa học có:
Thể tích dung dịch KMnO4 1 M đã phản ứng là 150 mL.
a) Viết phản ứng và cân bằng bằng phương pháp thăng bằng electron.
b) Xác định công thức của iron oxide.
Lời giải:
a) Viết phản ứng và cân bằng bằng phương pháp thăng bằng electron:
Phương trình hóa học:
b)
Dựa vào tỉ lệ phản ứng có:
Công thức của iron oxide là .
a) Hãy viết phương trình hóa học của phản ứng.
Lời giải:
Chú ý: Muốn biết lái xe có vi phạm luật hay không cần phải tính hàm lượng ethanol
trong máu người lái xe, sau đó so sánh với tiêu chuẩn cho phép để kết luận.
a) Phương trình hóa học của phản ứng chuẩn độ:
b) Theo phương trình hóa học có:
Số mol ethanol =
C% (ethanol) = = 0,11% > 0,02%
Vậy người lái xe phạm luật.
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Lý thuyết Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
I. Số oxi hóa
1. Tìm hiểu về số oxi hóa
- Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
Ví dụ: Giả định nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl khi đó có thể coi Cl nhận 1 electron và H nhường 1 electron.
⇒ Cl mang điện tích -1 và H mang điện tích +1.
⇒ Ta nói số oxi hóa của Cl là -1, của H là +1.
- Cách biểu diễn số oxi hóa: Số oxi hóa được đặt ở phía trên kí hiệu nguyên tố.
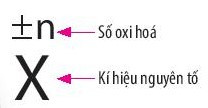
Ví dụ:
2. Xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
Quy tắc xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0.
Ví dụ:
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0.
Ví dụ: Tổng số oxi hóa của các nguyên tử trong phân tử NH3 là: (-3) × 1 + 3 × (+1) = 0.
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với các ion đa nguyên tử) bằng điện tích của ion đó.
Ví dụ: Số oxi hóa của nguyên tử Na trong ion Na+ là +1.
Trong ion HSO4- tổng số oxi hóa của các nguyên tử: 1.(+1) + 1.(+6) + 4.(-2) = -1
- Quy tắc 4: Trong đa số các hợp chất, số oxi hóa của hydrogen là +1, trừ các hydride kim loại như NaH, CaH2 …. Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide; superoxide (như H2O2; Na2O2; KO2 …). Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1; kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm có số oxi hóa +3. Số oxi hóa của các nguyên tử nguyên tố fluorine trong các hợp chất bằng -1.
|
Xác định số oxi hóa |
Số oxi hóa |
|
Đơn chất |
0 |
|
Phân tử |
Tổng số oxi hóa của các nguyên tử bằng 0 |
|
Ion đơn nguyên tử |
Bằng điện tích của ion |
|
Ion đa nguyên tử |
Tổng số oxi hóa các nguyên tử bằng điện tích ion |
|
Ion fluorine |
-1 |
|
Oxygen trong hợp chất (trừ OF2 và các peroxide, superoxide) |
-2 |
|
Hydrogen trong hợp chất (trừ các hydride) |
+1 |
II. Phản ứng oxi hóa – khử
- Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển dịch electron giữa các chất phản ứng hay phản ứng có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
- Chất khử (hay chất bị oxi hóa) là chất nhường electron hay chất có số oxi hóa tăng lên sau phản ứng.
- Chất oxi hóa (hay chất bị khử) là chất nhận electron hay chất có số oxi hóa giảm xuống sau phản ứng.
- Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình nhận electron.
- Trong phản ứng oxi hóa – khử luôn xảy ra đồng thời sự oxi hóa và sự khử.
Ví dụ: Xét phương trình hóa học:
+ ion S2- nhường electron (số oxi hóa tăng) nên là chất khử.
+ Br nhận electron nên là chất oxi hóa.
+ Quá trình nhường electron là quá trình oxi hóa:
+ Quá trình nhận electron là quá trình khử:
Chú ý:
+ Chất oxi hóa mạnh thường là các hợp chất chứa nguyên tử của các nguyên tố có số oxi hóa cao (như ) hoặc đơn chất của các nguyên tố có độ âm điện lớn (như F2, O2, Cl2, Br2, …)
+ Chất khử mạnh thường là các hợp chất chứa nguyên tử của các nguyên tố có số oxi hóa thấp (như ) hoặc đơn chất kim loại (như kim loại kiềm, kiềm thổ, …)
+ Chất chứa nguyên tử của nguyên tố có số oxi hóa trung gian (như thì tùy thuộc vào điều kiện phản ứng (tác nhân và môi trường) mà thể hiện tính khử hoặc tính oxi hóa hoặc cả hai (vừa tính oxi hóa, vừa tính khử hay tự oxi hóa – khử).
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
- Có nhiều phương pháp lập phương trình hóa học của phản ứng oxi hóa – khử. Phương pháp thông dụng hiện nay là thăng bằng electron.
- Nguyên tắc:
Tổng số electron chất khử nhường = Tổng số electron chất oxi hóa nhận.
- Các bước lập phương trình hóa học của phản ứng oxi hóa - khử theo phương pháp thăng bằng electron:
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử.
+ Bước 2: Viết quá trình oxi hóa, quá trình khử.
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron do chất khử nhường bằng tổng số electron chất oxi hóa nhận.
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử các nguyên tố còn lại.
Ví dụ:
Lập phương trình hóa học của phản ứng KMnO4 + HCl → KCl + MnCl2 + Cl↑ + H2O theo phương pháp thăng bằng electron.
Bước 1:
Chất khử: HCl
Chất oxi hóa: KMnO4
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
IV. Ý nghĩa của phản ứng oxi hóa – khử
- Một số phản ứng oxi hóa – khử quan trọng gắn liền với cuộc sống như sự cháy của than, củi; sự cháy của xăng, dầu trong các động cơ đốt trong; các quá trình điện phân; các phản ứng xảy ra trong pin, ắc quy …

- Một số phản ứng oxi hóa – khử là cơ sở của quá trình sản xuất trong các ngành công nghiệp nặng; sản xuất các hóa chất cơ bản; sản xuất phân bón; thuốc bảo vệ thực vật; dược phẩm …
