Với giải sách bài tập Hoá học 10 Ôn tập chương 4 sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Ôn tập chương 4
OT4.1 trang 49 SBT Hóa học 10. Sản xuất gang trong công nghiệp bằng cách sử dụng khí CO khử Fe2O3 ở nhiệt độ cao theo phản ứng sau:
Trong phản ứng trên chất đóng vai trò chất khử là:
A. Fe2O3
B. CO
C. Fe
D. CO2
Lời giải:
Đáp án đúng là: B.
Số oxi hóa của C tăng từ +2 lên +4 nên CO đóng vai trò là chất khử.
OT4. 2 trang 49 SBT Hóa học 10. Cho các phân tử có công thức cấu tạo sau:
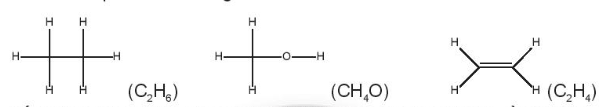
Số oxi hóa trung bình của nguyên tử C trong các phân tử trên lần lượt là:
A. - 3, - 2, - 2
B. – 3, - 3, - 2
C. – 2, - 2, - 2
D. – 3, - 2, - 3
Lời giải:
Đáp án đúng là: A.
+ C2H6
Số oxi hóa của H là +1; gọi số oxi hóa trung bình của C là x ta có:
2.x + 6.(+1) = 0 ⇒ x = -3.
+ CH4O
Số oxi hóa của H là +1; số oxi hóa của O là -2.
Gọi số oxi hóa trung bình của C là y ta có:
1.y + 4.(+1) + 1.(-2) = 0 ⇒ y = -2.
+ C2H4
Số oxi hóa của H là +1; gọi số oxi hóa trung bình của C là z ta có:
2.z + 4.(+1) = 0 ⇒ x = -2.
OT4.3 trang 49 SBT Hóa học 10. Thực hiện các phản ứng sau:
(a)
(b)
(c )
(d)
Số phản ứng chlorine đóng vai trò chất oxi hóa là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: B.
(a)
⇒ Chlorine vừa là chất oxi hóa – vừa là chất khử.
(b)
⇒ Chlorine vừa là chất oxi hóa – vừa là chất khử.
(c )
⇒ Chlorine là chất oxi hóa.
(d)
⇒ Chlorine là chất oxi hóa.
OT4.4 trang 49 SBT Hóa học 10. Bromine vừa là chất oxi hóa, vừa là chất khử trong phản ứng nào sau đây?
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: A.
Bromine vừa là chất oxi hóa, vừa là chất khử trong phản ứng:
OT4.5 trang 49 SBT Hóa học 10. Nguyên tử sulfur chỉ thể hiện tính khử (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
A. SO2
B. H2SO4
C. H2S
D. Na2SO3
Lời giải:
Đáp án đúng là: C
Số oxi hóa của sulfur trong các hợp chất: SO2; H2SO4; H2S; Na2SO3 lần lượt là +4; +6; -2; +4.
Trong H2S thì sulfur có số oxi hóa thấp nhất nên nguyên tử sulfur chỉ thể hiện tính khử (trong điều kiện phản ứng phù hợp) trong hợp chất H2S.
OT4.6 trang 49 SBT Hóa học 10. Tính số oxi hóa các nguyên tố có đánh dấu *:
a)
b)
Lời giải:
a)
Giải thích trường hợp:
Ta có trong hợp chất này Na có số oxi hóa +1; O có số oxi hóa -2; gọi số oxi hóa Cr là x:
2.(+1) + x + 4.(-2) = 0 ⇒ x = +6.
Học sinh làm tương tự với các phần còn lại.
b.
Giải thích trường hợp:
Ta có trong ion này, H có số oxi hóa +1, gọi số oxi hóa của N là y.
1.y + 4. (+1) = +1 ⇒ y = -3.
Học sinh làm tương tự với các phần còn lại.
OT4.7 trang 50 SBT Hóa học 10 Chất được gạch chân trong các phương trình hóa học sau đây là chất oxi hóa hay chất khử, nêu lí do.
a.
B.
C.
Lời giải:
a)
Br2 là chất oxi hoá do số oxi hoá của Br giảm từ 0 xuống -1 sau phản ứng.
b)
Zn là chất khử do số oxi hoá tăng từ 0 lên +2 sau phản ứng.
c)
K2Cr2O7 là chất oxi hoá do số oxi hoá của Cr giảm từ +6 xuống +3 sau phản ứng.
OT4.8 trang 50 SBT Hóa học 10. Dẫn ra hai phản ứng, trong đó có một phản ứng oxi hóa – khử và một không phải phản ứng oxi hóa – khử.
Lời giải:
- Phản ứng oxi hoá - khử:
;
Phản ứng không phải oxi hoá - khử:
OT4.9 trang 50 SBT Hóa học 10. Dưới tác dụng của các chất xúc tác, glucose tạo thành các sản phẩm khác nhau.
- Lên men tạo thành ethanol:
(1)
(glucose) (ethanol)
- Ethanol lên men thành acetic acid:
(2)
(acetic acid)
a) Cho biết vai trò của các chất trong các phản ứng (1) và (2).
b) Tính lượng glucose cần dùng để thu được 1 lít acetic acid 1M. Giả sử hiệu suất của cả quá trình là 50%.
Lời giải:
a) Vai trò của các chất:
Glucose vừa là chất oxi hoá, vừa là chất khử.
CH3CH2OH (hay C2H6O) là chất khử; O2 là chất oxi hóa.
b)
Theo sơ đồ phản ứng, khối lượng của glucose là: 0,5.180 = 90 gam.
Do hiệu suất của cả quá trình là 50%. Khối lượng glucose cần dùng là:
OT4.10 trang 50 SBT Hóa học 10. Ion Ca2+ cần thiết cho máu của người hoạt động bình thường. Nồng độ ion calcium không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC2O4) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng sau:
a) Cân bằng phương trình phản ứng.
b) Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng vừa hết với 2,05 mL dung dịch potassium permanganate (KMnO4) 4,88.10-4M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca2+/100 mL máu.
Lời giải:
a) Cân bằng phương trình phản ứng:
Phương trình phản ứng:
b) Số mol KMnO4 cần dùng để phản ứng hết với calcium oxalate kết tủa từ 1 mL
máu là: 10-6 mol
Xét sơ đồ:
Khối lượng ion calcium (mg) trong 100 mL máu là:
.
OT4.11 trang 50 SBT Hóa học 10. Hỗn hợp ammonium perchlorate (NH4ClO4) và bột nhôm là nhiên liệu rắn của tàu vũ trụ con thoi theo phản ứng sau:
Mỗi một lần phóng tàu con thoi tiêu tốn 750 tấn ammonium perchlorate. Giả sử tất cả oxygen sinh ra tác dụng với bột nhôm, hãy tính khối lượng nhôm phản ứng với oxygen và khối lượng aluminium oxide sinh ra.
Lời giải:
Số mol oxygen = Số mol ammonium perchlorate =
Số mol aluminium phản ứng với O2:
Khối lượng aluminum phản ứng: 230 tấn
Số mol aluminum oxide sinh ra:
Khối lượng aluminum oxide sinh ra: 434 tấn.
OT4.12 trang 50 SBT Hóa học 10. Cho 30,3 g hỗn hợp Al và Zn tác dụng vừa đủ với 11,15 lít O2 (đkc), thu được hỗn hợp các oxide. Viết các phương trình phản ứng xảy ra và tính khối lượng các oxide tạo thành.
Lời giải:
Gọi Al: x mol và Zn: y mol.
Số mol O2:
Phương trình hóa học xảy ra:
Theo khối lượng ta có: 27x + 65y = 30,3 (1)
Theo số mol O2 ta có:
Từ (1) và (2) giải hệ phương trình được: x = 0,4; y = 0,3;
Khối lượng là 0,2.102 = 20,4 g và khối lượng ZnO là 0,3. 81 = 24,3 g.
OT4.13 trang 51 SBT Hóa học 10. Sodium peroxide (Na2O2), potassium superoxide (KO2) là những chất oxi hóa mạnh, dễ dàng hấp thụ khí carbon dioxide và giải phóng khí oxygen. Do đó, chúng được sử dụng trong bình lặn hoặc tàu ngầm để hấp thụ khí carbon dioxide và cung cấp khí oxygen cho con người trong hô hấp theo các phản ứng sau:

a) Cân bằng các phản ứng biết rằng nguyên tử oxygen trong Na2O2, KO2 là nguyên tố tự oxi hóa – khử.
b) Theo nghiên cứu, khi hô hấp, thể tích khí carbon dioxide một người thải ra xấp xỉ thể tích khí oxygen hít vào. Cần trộn Na2O2 và KO2 theo tỉ lệ số mol như thế nào để thể tích khí carbon dioxide hấp thụ bằng thể tích khí oxygen sinh ra?
Lời giải:
a) Cân bằng các phản ứng:
-
Phương trình phản ứng:
-
Phương trình phản ứng:
b) Dựa vào phản ứng với khí CO2 cần trộn với KO2 theo tỉ lệ 1 : 2 về số mol thì thể tích khí O2 sinh ra sẽ bằng thể tích của khí CO2 được hấp thụ theo phản ứng sau:
OT4.14 trang 51 SBT Hóa học 10. Copper(II) sulfate được sử dụng làm nguyên liệu trong phân bón, làm thuốc kháng nấm. Ngoài ra, còn dùng để diệt rêu – tảo trong bể bơi, … Copper(II) sulfate được sản xuất chủ yếu sử dụng từ nguồn nguyên liệu tái chế. Phế liệu được tinh chế cùng kim loại nóng chảy được đổ vào nước để tạo thành những mảnh xốp. Hỗn hợp này được hòa tan trong dung dịch sulfuric acid loãng trong không khí theo phương trình:
(1)
Ngoài ra, copper(II) sulfate còn được điều chế bằng cách cho đồng phế liệu tác dụng với dung dịch sunfuric acid đặc, nóng:
(2)

a. Cân bằng 2 phản ứng trên theo phương pháp thăng bằng electron.
b. Trong hai cách trên, cách nào ít làm ô nhiễm môi trường hơn?
Lời giải:
a) Cân bằng 2 phương trình hóa học:
- Phương trình 1:
Phương trình phản ứng:
- Phương trình 2:
Phương trình phản ứng:
b) Cách thứ nhất (cách có phương trình phản ứng 1) ít làm ô nhiễm môi trường hơn do không thải khí SO2 ra môi trường.
OT4.15 trang 51 SBT Hóa học 10. Cho 1,12 g kim loại X tác dụng với dung dịch sulfuric acid đặc, nóng, dư thu được0,7437 lít khí SO2(đkc) và muối X2(SO4)3.
a) Viết phản ứng và cân bằng phương trình hóa học theo phương pháp thăng bằng electron.
b) Xác định kim loại X.
Lời giải:
a) Viết phản ứng và cân bằng phương trình hóa học:
Phương trình hóa học:
b)
Theo phương trình hóa học ta có:
. Vậy X là kim loại iron (Fe)
Phương trình hoá học:
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Ôn tập chương 4
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Ôn tập chương 5