Với giải sách bài tập Hoá học 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10. Mời các bạn đón xem:
Giải SBT Hoá học lớp 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 13.1 trang 52 SBT Hóa học 10. Cho phương trình nhiệt hóa học của phản ứng:
C. không có sự thay đổi năng lượng
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Lời giải:
Đáp án đúng là: B.
Phản ứng trên là phản ứng tỏa nhiệt.
Bài 13.2 trang 52 SBT Hóa học 10. Cho phương trình nhiệt hóa học của phản ứng
B. không có sự thay đổi năng lượng
D. có sự giải phóng nhiệt lượng ra môi trường
Lời giải:
Đáp án đúng là: A.
Phản ứng trên là phản ứng thu nhiệt.
Bài 13.3 trang 52 SBT Hóa học 10. Dựa vào phương trình nhiệt hóa học của phản ứng sau:
Lời giải:
Đáp án đúng là: C.
Theo phương trình nhiệt học, phản ứng phân hủy 1 mol CO2 thu được 1 mol CO và 0,5 mol O2 cần thu 280kJ nhiệt.
Vậy để phân hủy 2 mol CO2 thu được 2 mol CO và 1 mol O2 cần thu 280.2 = 560 kJ nhiệt.
Giá trị của phản ứng là +560 kJ.
Bài 13.4 trang 52 SBT Hóa học 10. Phương trình nhiệt hóa học:
Lượng nhiệt tỏa ra khi dùng 9 g H2(g) để tạo thành NH3(g) là
Lời giải:
Đáp án đúng là: B.
9 gam H2 tương đương với 4,5 mol.
Theo đề bài, phản ứng của 3 mol H2 thể khí với 1 mol N2 thể khí tạo 2 mol NH3 thể khí giải phóng 91,8 kJ nhiệt.
Vậy phản ứng của 9 gam H2 (tương đương với 4,5 mol) ở thể khí tạo thành NH3 ở thể khí giải phóng: nhiệt.
Bài 13.5 trang 53 SBT Hóa học 10. Điều kiện nào sau đây không phải là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 298K
C. Áp suất 1 bar và nhiệt độ 25oC
D. Áp suất 1 bar và nhiệt độ 25K
Lời giải:
Đáp án đúng là: D.
Chú ý: Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K (25oC).
Bài 13.6 trang 53 SBT Hóa học 10. Dựa vào phương trình nhiệt hóa học của các phản ứng sau:
A. (1) và (2)
B. (3) và (4)
C. (1) và (3)
D. (2) và (4)
Lời giải:
Đáp án đúng là: D.
Phản ứng (2) và (4) có nên là phản ứng thu nhiệt.
Bài 13.7 trang 53 SBT Hóa học 10. Dựa vào phương trình nhiệt hóa học của phản ứng sau:
Lời giải:
Đáp án đúng là: A.
Do
Nên
Bài 13.8 trang 53 SBT Hóa học 10.
a) Enthalpy tạo thành của hợp chất là gì?
b) Biến thiên enthalpy tạo thành trong các phản ứng hóa học là gì?
c) Enthalpy tạo thành khác với enthalpy tạo thành chuẩn ở điểm nào?
d) Tại sao enthalpy tạo thành chuẩn của đơn chất lại bằng không?
Lời giải:
a) Enthalpy tạo thành của một chất là lượng nhiệt kèm theo phản ứng tạo thành 1 mol
chất đó từ các đơn chất bền.
b) Biến thiên enthalpy tạo thành trong các phản ứng hoá học là lượng nhiệt toả ra hay thu vào của một phản ứng hoá học ( được tính theo đơn vị kJ hoặc kcal).
c) Enthalpy tạo thành được đo trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) và được kí hiệu là
d) Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất là lượng nhiệt kèm theo của phản ứng tạo thành một mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn. Đơn chất bền nên không có sự biến đổi, enthalpy tạo thành bằng 0.
Bài 13.9 trang 53 SBT Hóa học 10. Các quá trình sau đây là tỏa nhiệt hay thu nhiệt?
c) Quá trình chạy của con người
e. Hòa tan KBr vào nước làm cho nước trở nên lạnh
g) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
Lời giải:
a) Nước hoá rắn là quá trình toả nhiệt.
b) Sự tiêu hoá thức ăn là quá trình thu nhiệt.
c) Quá trình chạy của con người là quá trình toả nhiệt.
d) Khí CH4 đốt ở trong lò là quá trình toả nhiệt.
e) Hoà tan KBr vào nước làm cho nước trở nên lạnh là quá trình thu nhiệt.
g) Thêm sulfuric acid đặc vào nước, nước nóng lên là quá trình toả nhiệt.
Bài 13.10 trang 54 SBT Hóa học 10. Hãy nêu 1 phản ứng tỏa nhiệt và 1 phản ứng thu nhiệt mà em biết.
Lời giải:
- Cho kim loại iron (Fe) tác dụng với giấm (CH3COOH – acetic acid). Phương trình nhiệt hoá học:
⇒ Phản ứng toả nhiệt.
- Cho NaHCO3 tác dụng với acid. Phương trình nhiệt hoá học:
⇒ Phản ứng thu nhiệt.
Hãy dự đoán phản ứng trên là tỏa nhiệt hay thu nhiệt.
Lời giải:
Phản ứng nhiệt phân ammonium nitrate là phản ứng thu nhiệt do phải cung cấp nhiệt năng.
Lời giải:
Các đơn chất C (graphite, s), Br2 (l), Na (s), Hg(l), bền có .
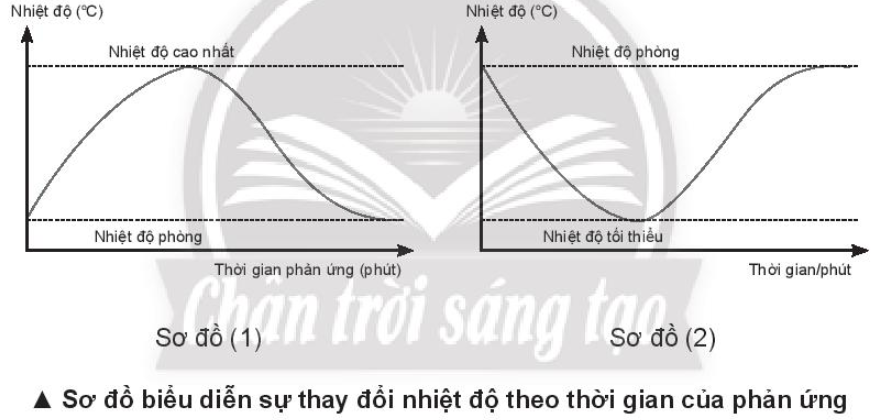
Lời giải:
- Sơ đồ (1) chỉ quá trình toả nhiệt, do nhiệt độ phản ứng tăng so với nhiệt độ ban đầu (nhiệt độ phòng).
- Sơ đồ (2) chỉ quá trình thu nhiệt, do nhiệt độ phản ứng giảm so với nhiệt độ ban đầu (nhiệt độ phòng).
Lời giải:
Phương trình nhiệt hoá học của các phản ứng:
a. Phản ứng tạo thành Al2O3
b. Phản ứng tạo thành NO.
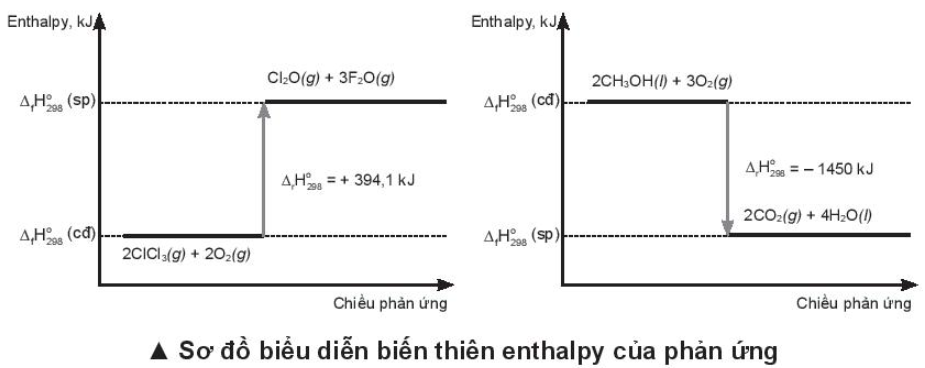
Lời giải:
Phương trình nhiệt hoá học ứng với sơ đồ:
Bài 13.17 trang 55 SBT Hóa học 10. Cho phản ứng:
a. Lấy gấp 3 lần khối lượng của các chất phản ứng.
b. Lấy một nửa khối lượng của các chất phản ứng
Lời giải:
a) Lấy gấp 3 lần khối lượng của các chất phản ứng:
b) Lấy một nửa khối lượng của các chất phản ứng:
c) Đảo chiều của phản ứng:
Lời giải:
Số mol N2: .
Để tạo 1 mol NH3 cần 0,5 mol N2.
Phương trình nhiệt hoá học:
a) Nước ở trạng thái khí, biết rằng khi tạo thành 1 mol hơi nước tỏa ra 214,6 kJ nhiệt.
b) Nước lỏng, biết rằng sự tạo thành 1 mol nước lỏng tỏa ra 285,49 kJ nhiệt.
c) Ammonia (NH3), biết rằng sự tạo thành 2,5 g ammonia tỏa ra 22,99 kJ nhiệt.
Lời giải:
a) Khi tạo thành 1 mol hơi nước tỏa ra 214,6 kJ nhiệt, phương trình nhiệt hóa học của quá trình là:
b) Sự tạo thành 1 mol nước lỏng tỏa ra 285,49 kJ nhiệt, phương trình nhiệt hóa học của quá trình là:
c) Sự tạo thành 2,5 g ammonia tỏa ra 22,99 kJ nhiệt:
Số mol ammonia =
Sự tạo thành 1 mol ammonia toả ra 156,33 kJ nhiệt.
Tạo thành 2 mol ammonia toả ra 156,33.2 = 312,66 kJ nhiệt.
Phương trình nhiệt hóa học của quá trình là:
d) Để thu được 11,2 g vôi (CaO) phải cung cấp 6,94 kcal:
Số mol vôi bằng 0,2 mol, vậy để thu được 1 mol vôi cần cung cấp 6,94.5 = 34,7 kcal.
Phương trình nhiệt hóa học của quá trình là:
Lời giải:
. Thứ tự giảm dần độ bền nhiệt là
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Lý thuyết Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
I. Phản ứng tỏa nhiệt
- Phản ứng tỏa nhiệt là phản ứng có sự giải phóng nhiệt năng ra môi trường.
- Ví dụ:
+ Phản ứng nhiệt nhôm tỏa một lượng nhiệt rất lớn làm nóng chảy hỗn hợp chất phản ứng và sắt sinh ra. Ứng dụng để hàn đường ray
2Al + Fe2O3 Al2O3 + 2Fe
+ Phản ứng đốt cháy than tỏa một lượng nhiệt lớn giúp nấu chín thức ăn và sưởi ấm.
C + O2 CO2
II. Phản ứng thu nhiệt
- Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
Ví dụ: Phản ứng nung đá vôi là phản ứng thu nhiệt:
CaCO3(s) CaO(s) + CO2(g)
Nếu ngừng cung cấp nhiệt thì phản ứng sẽ không tiếp tục xảy ra.
III. Biến thiên enthalpy chuẩn của phản ứng
1. Biến thiên enthalpy của phản ứng
- Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu là ∆rH, thường tính theo đơn vị kJ hoặc kcal.
- Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp (áp suất không đổi).
- Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hóa học, được kí hiệu , là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn.
- Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/ L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K).
2. Phương trình nhiệt hóa học
- Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (sp).
- Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì .
- Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì
Ví dụ:
C(s) + H2O(g) CO(g) + H2(g) ∆ r = +131,25 kJ > 0 (1)
⇒ Phản ứng (1) là phản ứng thu nhiệt.
CuSO4 (aq) + Zn(s) → ZnSO4(aq) + Cu(s) ∆ r = -231,04 kJ < 0 (2)
⇒ Phản ứng (2) là phản ứng tỏa nhiệt.
IV. Enthalpy tạo thành (nhiệt tạo thành)
- Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
- Enthalpy tạo thành (hay nhiệt tạo thành) được kí hiệu bằng ∆fH, thường được tính theo đơn vị kJ/ mol hoặc kcal/ mol.
- Enthalpy tạo thành trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) và được kí hiệu là .
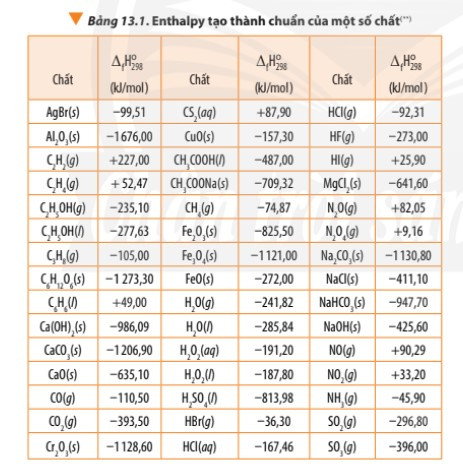
Chú ý:
1. của đơn chất bền nhất bằng 0 (xét ở điều kiện chuẩn).
2. < 0, chất bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó.
3. > 0, chất kém bền hơn mặt năng lượng so với các đơn chất bền tạo nên nó.
V. Ý nghĩa của dấu và giá trị
- Phản ứng tỏa nhiệt:
- Phản ứng thu nhiệt:
- Thường các phản ứng có < 0 thì xảy ra thuận lợi.
Chú ý: Phản ứng thu nhiệt cần cung cấp nhiệt liên tục, nếu dừng cung cấp nhiệt phản ứng sẽ không tiếp diễn