Với giải Bài 2.3 trang 7 SBT Hóa Học lớp 11 Cánh diều chi tiết trong Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa Học 11 . Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Bài 2.3 trang 7 SBT Hóa học 11: Phương trình mô tả sự điện li của NaCl trong nước là
Lời giải:
Đáp án đúng là: C
Sự điện li là quá trình một chất khi hòa tan trong nước (hoặc một số dung môi phân cực khác) sẽ phân ly thành các ion mang điện tích dương (cation) và ion mang điện tích âm (anion).
Điều kiện: Không phải tất cả các chất khi hòa tan vào nước đều điện li. Chỉ những chất điện li mới có khả năng này.
Vai trò của nước: Nước đóng vai trò là dung môi phân cực, có khả năng phá vỡ các liên kết ion trong chất tan, giúp các ion tự do di chuyển.
NaCl là chất điện li nên khi hòa tan vào nước sẽ tạo ra các ion. Các phân tử nước có cực (một đầu mang điện tích dương, một đầu mang điện tích âm) sẽ bao quanh các ion Na⁺ và Cl⁻. Lực hút giữa các phân tử nước và các ion sẽ lớn hơn lực hút giữa các ion Na⁺ và Cl⁻ trong tinh thể. Kết quả là, các liên kết ion trong tinh thể NaCl bị phá vỡ, các ion Na⁺ và Cl⁻ tách ra khỏi mạng tinh thể và được các phân tử nước bao quanh.
Phương trình điện li:
Xem thêm lời giải Sách bài tập Vật lí lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 2.1 trang 7 SBT Hóa học 11: Điền từ ngữ thích hợp vào các chỗ trống trong mỗi phát biểu sau:...
Bài 2.3 trang 7 SBT Hóa học 11: Phương trình mô tả sự điện li của NaCl trong nước là...
Bài 2.4 trang 7 SBT Hóa học 11: Phương trình mô tả sự điện li của Na2CO3 trong nước là...
Bài 2.6 trang 8 SBT Hóa học 11: Đặc điểm nào sau đây là không đúng khi mô tả về acid mạnh?...
Bài 2.7 trang 8 SBT Hóa học 11: Đặc điểm nào sau đây là không đúng khi mô tả về base yếu?...
Bài 2.10 trang 8 SBT Hóa học 11: Base liên hợp của các acid 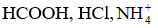
Bài 2.11 trang 8 SBT Hóa học 11: Cho phản ứng:...
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác: