Với giải Câu hỏi thảo luận 5 trang 25 Hóa học lớp 11 Chân trời sáng tạo chi tiết trong Bài 4: Ammonia và một số hợp chất ammonium giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 4: Ammonia và một số hợp chất ammonium
Câu hỏi thảo luận 5 trang 25 Hóa học 11: Chuẩn bị hai đầu đũa thuỷ tinh quấn bông. Đũa 1 nhúng vào dung dịch HCl đặc, đũa 2 nhúng vào dung dịch NH3 đặc, sau đó đưa lại gần nhau (Hình 4.3). Quan sát và nêu hiện tượng xảy ra. Từ đó, đề xuất phương pháp nhận biết ammonia bằng dung dịch HCl đặc.
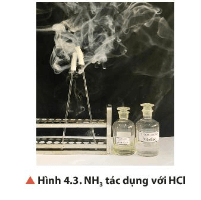
Lời giải:
- Hiện tượng: Có khói trắng xuất hiện.
- Phương pháp nhận biết ammonia bằng dung dịch HCl đặc: Mở nắp hai bình đựng hai dung dịch để cạnh nhau, nếu có khói trắng xuất hiện Þ bình hoá chất cần nhận biết là ammonia.
Phương trình hoá học: NH3 + HCl → NH4Cl.
Lý thuyết Tính chất của Ammonia
a. Tìm hiểu tính chất vật lí của Ammonia
- Ammonia là chất khí không màu, có mùi khai, xốc và nhẹ hơn không khí
- Tan nhiều trong nước → dung dịch Ammonia có nồng độ 25%
b. Tìm hiểu tính chất hóa học của Ammonia
* Ammonia có tính khử và tính base:
- Ammonia tan trong nước tạo thành ion ammonium NH4+ và giải phóng ion OH-
NH3 + H2O ⇌ NH4+ + OH-
- Ammonia tác dụng với Acid (HCl, H2SO4) → muối ammonium
- Ammonia cháy trong khí oxy → nitrogen và hơi nước
- Khi có xúc tác Pt, ở nhiệt độ cao tạo thành NO và H2O
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 24 Hóa học 11: Ammonia là một hợp chất của hydrogen và nitrogen, có rất nhiều ứng dụng trong đời sống và sản xuất. Ammonia có những tính chất và ứng dụng gì?...
Câu hỏi thảo luận 1 trang 24 Hóa học 11: Quan sát Hình 4.1, mô tả cấu tạo của phân tử ammonia. Dự đoán tính tan (trong nước) và tính oxi hoá – khử của ammonia. Giải thích....
Câu hỏi thảo luận 2 trang 25 Hóa học 11: Quan sát Hình 4.2, giải thích hiện tượng thí nghiệm. Từ đó cho biết, tại sao không thu khí ammonia bằng phương pháp đẩy nước....
Câu hỏi thảo luận 3 trang 25 Hóa học 11: Tính tỉ khối của NH3 so với không khí. Từ kết quả đó, hãy giải thích vì sao có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình)....
Câu hỏi thảo luận 4 trang 25 Hóa học 11: Từ sự kết hợp giữa NH3 với nước, nhận xét tính acid – base của NH3 trong dung dịch. Nêu cách nhận biết khí NH3 bằng quỳ tím. Giải thích....
Câu hỏi thảo luận 5 trang 25 Hóa học 11: Chuẩn bị hai đầu đũa thuỷ tinh quấn bông. Đũa 1 nhúng vào dung dịch HCl đặc, đũa 2 nhúng vào dung dịch NH3 đặc, sau đó đưa lại gần nhau (Hình 4.3). Quan sát và nêu hiện tượng xảy ra. Từ đó, đề xuất phương pháp nhận biết ammonia bằng dung dịch HCl đặc....
Câu hỏi thảo luận 6 trang 26 Hóa học 11: Cho biết ammonia thể hiện tính chất gì trong phản ứng với acid và oxygen....
Câu hỏi thảo luận 7 trang 26 Hóa học 11: Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, hãy cho biết để tăng hiệu suất tổng hợp NH3, cần điều chỉnh nhiệt độ và áp suất như thế nào. Điều đó có gây trở ngại gì cho phản ứng tổng hợp NH3 trên thực tế hay không? Vì sao?...
Câu hỏi thảo luận 8 trang 27 Hóa học 11: Quan sát Hình 4.5, cho biết trạng thái, màu sắc của muối ammonium chloride và đặc tính liên kết của phân tử....
Câu hỏi thảo luận 9 trang 27 Hóa học 11: Quan sát Thí nghiệm, nêu hiện tượng xảy ra. Giải thích. Viết phương trình hoá học khi cho NH4Cl, NH4NO3, (NH4)2SO4 tác dụng với dung dịch NaOH....
Câu hỏi thảo luận 10 trang 28 Hóa học 11: Đun nóng NH4Cl (Hình 4.6) thấy có hiện tượng khói trắng trong ống nghiệm. Giải thích....
Luyện tập trang 28 Hóa học 11: Viết phương trình hoá học khi cho dung dịch (NH4)2CO3 tác dụng với các dung dịch KOH, HCl, Ba(OH)2, CaCl2....
Vận dụng trang 28 Hóa học 11: NH4HCO3 là một trong những chất được dùng làm bột nở trong sản xuất bánh bao. Giải thích....
Câu hỏi thảo luận 11 trang 28 Hóa học 11: Tìm hiểu thông tin và nêu một số ứng dụng của ammonia trong đời sống và sản xuất....
Vận dụng trang 29 Hóa học 11: Hãy giải thích vì sao các loại phân bón như NH4Cl, NH4NO3, (NH4)2SO4 không thích hợp bón cho đất chua....
Bài 1 trang 29 Hóa học 11: Liên kết hoá học trong phân tử NH3 là liên kết...
Bài 2 trang 29 Hóa học 11: Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là...
Bài 3 trang 29 Hóa học 11: Khi thải rác thải sinh hoạt chứa một lượng lớn ion ammonium vào ao, hồ sẽ xảy ra quá trình oxi hoá ammonium thành ion nitrate dưới tác dụng của vi khuẩn. Quá trình này làm giảm oxygen hoà tan trong nước, gây ngạt cho sinh vật sống dưới nước. Người ta phải xử lí nguồn nước gây ô nhiễm đó bằng cách chuyển ion ammonium thành ammonia rồi chuyển tiếp thành nitrogen không độc. Hãy đề xuất một số hoá chất để thực hiện quá trình trên và viết phương trình hoá học của các phản ứng xảy ra....
Bài 4 trang 29 Hóa học 11: Cho cân bằng hoá học:...
Bài 5 trang 29 Hóa học 11: Viết phương trình hoá học của các phản ứng xảy ra khi cho dung dịch (NH4)2SO4 tác dụng với dung dịch NaOH, dung dịch Ba(OH)2, dung dịch BaCl2, dung dịch Ba(NO3)2....
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 3: Đơn chất nitrogen
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate