Lời giải bài tập Hóa học lớp 11 Bài 7: Sulfuric acid và muối sulfate sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 7 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 7: Sulfuric acid và muối sulfate
Lời giải:
- Tính chất vật lí của sulfuric acid: chất lỏng, sánh như dầu, không màu, không bay hơi, nặng gần gấp hai lần nước (H2SO4 98% có khối lượng riêng là 1,84 g/cm3).
- Tính chất hoá học của sulfuric acid:
+ Dung dịch sulfuric acid loãng là một trong những acid mạnh và có tính chất chung của acid.
+ Dung dịch sulfuric acid đặc có tính oxi hoá mạnh và tính háo nước.
- Ứng dụng của sulfuric acid: dùng trong sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu …
1. Sulfuric acid
Lời giải:
Sulfuric acid là chất lỏng, sánh như dầu, không màu, không bay hơi.
Sulfuric acid không bay hơi do với cấu tạo gồm các nguyên tử hydrogen linh động và các nguyên tử oxygen có độ âm điện lớn, giữa các phân tử sulfuric acid hình thành nhiều liên kết hydrogen:
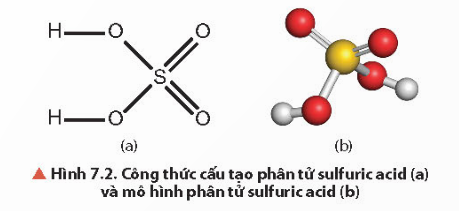
Câu hỏi thảo luận 2 trang 41 Hóa học 11: Quan sát Hình 7.2, mô tả cấu tạo phân tử của H2SO4.
Lời giải:
- Liên kết trong phân tử H2SO4 là liên kết cộng hoá trị.
- Phân tử H2SO4 có 2 nguyên tử hydrogen linh động, nguyên tử sulfur tạo được 6 liên kết cộng hoá trị với các nguyên tử oxygen.
Lời giải:
a) Hiện tượng: Có kết tủa trắng xuất hiện.
Phương trình hoá học: H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O.
b) Hiện tượng: Có khí thoát ra.
Phương trình hoá học: H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2O.
Lời giải:
Quá trình oxi hoá:
Quá trình khử:
Câu hỏi thảo luận 5 trang 41 Hóa học 11: Giải thích hiện tượng xảy ra trong Thí nghiệm 2.
Lời giải:
Hiện tượng: Đường tinh luyện dần dần hoá than, có hiện tượng sủi bọt đẩy C trào ra ngoài cốc.
Giải thích hiện tượng: Dung dịch sulfuric acid đặc có khả năng lấy nước từ các hợp chất carbohydrate như đường tinh luyện và khiến chúng hoá đen (hiện tượng than hoá). Sau đó một phần C sinh ra tiếp tục phản ứng với H2SO4 đặc tạo thành các khí CO2, SO2. Các khí này thoát ra đẩy C trào lên khỏi miệng cốc.
Phương trình hoá học minh hoạ:
C12H22O11 12C + 11H2O
C + 2H2SO4 (đặc) → CO2↑ + 2SO2↑ + 2H2O.
Lời giải:
2KBr + 3H2SO4 → 2KHSO4 + Br2 + SO2 + 2H2O
C + 2H2SO4 (đặc) → CO2↑ + 2SO2↑ + 2H2O.
Lời giải:
Cách pha loãng sulfuric acid: Cho từ từ acid vào nước và khuấy nhẹ bằng đũa thuỷ tinh. Tuyệt đối không làm ngược lại do sẽ làm nước sôi đột ngột kéo theo những giọt acid bắn ra ngoài gây nguy hiểm.
Lời giải:
Khi bỏng acid, cần nhanh chóng bỏ quần áo bị dính acid, sau đó rửa ngay bằng nước sạch khoảng 20 phút. Tiếp theo, cần nhanh chóng chuyển người bị bỏng đến cơ sở y tế gần nhất để được theo dõi và điều trị.
Lời giải:
2SO2(g) + O2(g) 2SO3(g)
Phản ứng có < 0 nên là phản ứng toả nhiệt.
Tuy nhiên nếu hạ nhiệt độ xuống thấp thì sự chuyển động của các phân tử khí giảm dẫn đến giảm hiệu suất phản ứng. Do đó, để đạt hiệu suất phản ứng cao, thực nghiệm cho thấy cần chọn nhiệt độ phản ứng trong khoảng 450 oC – 500 oC.
Lời giải:
Giai đoạn 1: Sản xuất sulfur dioxide (SO2) có nguy cơ cao gây ô nhiễm môi trường.
Cụ thể:
+ Việc khai thác nguyên liệu (sulfur hoặc quặng pyrite sắt) tiềm ẩn nhiều nguy cơ gây ô nhiễm môi trường.
+ Việc đốt nguyên liệu (sulfur hoặc quặng pyrite sắt) cần một lượng lớn nhiên liệu, khí thải khi đốt các nhiên liệu này góp phần gây ô nhiễm môi trường.
+ Ngoài ra, trong quá trình sản xuất làm thất thoát SO2 ra môi trường cũng là một trong những nguyên nhân gây ô nhiễm môi trường.
2. Muối sulfate
Lời giải:
Muối sulfate có nhiều ứng dụng trong đời sống và sản xuất.
- Calcium sulfate (CaSO4) được dùng trong sản xuất vật liệu xây dựng; làm chất phụ gia để làm đông các sản phẩm như đậu hũ, đậu non…
- Barium sulfate (BaSO4) được sử dụng như một loại bột màu làm phụ gia pha màu cho công nghiệp sơn, cho thuỷ tinh, cho gốm sứ cách điện và cao su chất lượng cao…
- Magnesium sulfate (MgSO4) được sử dụng sản xuất muối tắm; làm giảm dịu cơ bắp khi sưng tấy cho con người; bổ sung magnesium cho tôm, cá, động vật thuỷ sinh khác, …
- Ammonium sulfate (NH4)2SO4 là thành phần của thuốc trừ sâu hoà tan, thuốc diệt nấm, phân bón, sử dụng kết hợp với chlorine để tạo monochloramine để khử trùng nước uống…
Lời giải:
Thuốc thử để nhận biết ion sulfate SO42- (trong dung dịch H2SO4 hoặc dung dịch muối sulfate) là ion Ba2+ (trong dung dịch muối barium hoặc dung dịch Ba(OH)2).
Hiện tượng: Xuất hiện kết tủa trắng.
Phương trình hoá học: Ba2+ + SO42- → BaSO4.
Bài tập (trang 45)
A. Tính háo nước.
B. Tính oxi hoá.
C. Tính acid.
D. Tính khử.
Lời giải:
Đáp án đúng là: D
Tính khử không phải là tính chất hoá học đặc trưng của dung dịch sulfuric acid đặc.
A. Ba(OH)2.
B. BaCl2.
C. Ba(NO3)2.
D. MgCl2.
Lời giải:
Đáp án đúng là: D
MgCl2 không phản ứng với K2SO4.
Lời giải:
Khí được sulfuric acid đặc làm khô phải không tác dụng được với sulfuric acid đặc.
Các khí có thể được làm khô bằng sulfuric acid đặc là: H2, CO2, SO2, O2.
Lời giải:
Trích mẫu thử.
Cho lần lượt từng mẫu thử tác dụng với dung dịch H2SO4.
+ Nếu có kết tủa xuất hiện → mẫu thử là Ba(NO3)2.
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3.
+ Nếu có khí thoát ra → mẫu thử là K2CO3.
K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O.
+ Nếu không có hiện tượng gì xuất hiện → mẫu thử là Na2SO4.
Hãy cho biết A, B, C và D là kí hiệu của những chất nào. Giải thích và viết phương trình hoá học của các phản ứng xảy ra.
Lời giải:
Chất B làm xanh quỳ tím và không tạo kết tủa với dung dịch BaCl2 nên chất B là NaOH.
Chất C không làm đổi màu quỳ tím và không tạo kết tủa với dung dịch BaCl2 nên chất C là H2O.
Chất D làm quỳ tím chuyển sang màu đỏ và không tạo kết tủa với dung dịch BaCl2 nên chất D là HCl.
Chất A làm quỳ tím chuyển sang màu đỏ và tạo kết tủa với dung dịch BaCl2 nên chất A là H2SO4.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl.
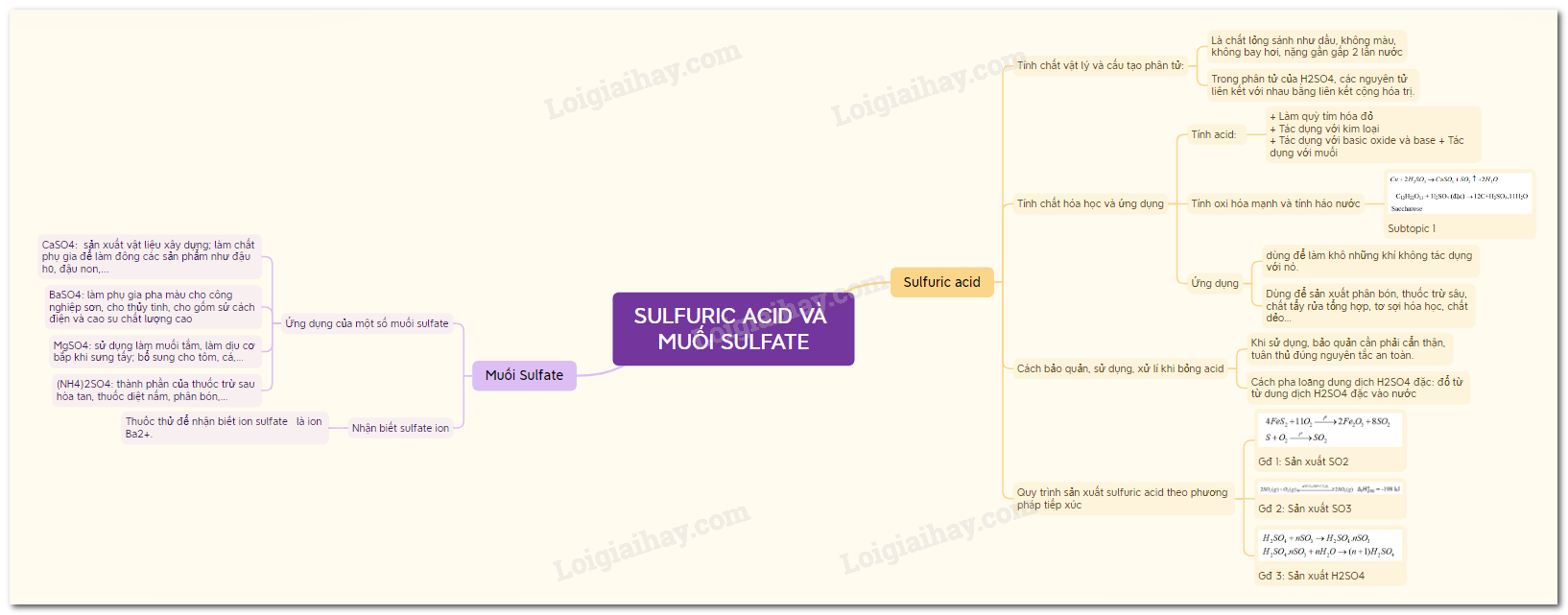
Lý thuyết Sulfuric acid và muối sulfate
1. Sulfuric acid
a) Tính chất vật lý và cấu tạo phân tử:
- Là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84g/cm3).
- Trong phân tử của H2SO4, các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. 2 liên kết đơn O – H, 2 liên kết đơn O – S và 2 liên kết đôi S = O.
b) Tính chất hóa học và ứng dụng
- Dung dịch H2SO4 loãng có tính chất chung của acid như:
+ Làm quỳ tím hóa đỏ
+ Tác dụng với kim loại
+ Tác dụng với basic oxide và base
+ Tác dụng với muối
-Dung dịch H2SO4 đặc, nóng có tính oxi hóa mạnh và tính háo nước
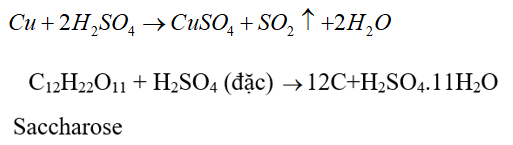
- Ứng dụng
+ Sulfuric acid đặc hấp thụ mạnh hơi nước nên được dùng để làm khô những khí không tác dụng với nó.
+ Dùng để sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo…
c) Cách bảo quản, sử dụng và nguyên tắc xử lí khi bỏng acid
- Khi sử dụng, bảo quản dung dịch sulfuric acid cần phải cẩn thận, tuân thủ đúng nguyên tắc an toàn.
- Cách pha loãng dung dịch H2SO4 đặc: đổ từ từ dung dịch H2SO4 đặc vào nước, tuyệt đối không làm ngược lại.
- Khi bị bỏng acid cần nhanh chóng bỏ quần áo bị dính acid, rửa ngay bằng nước sạch khoảng 20 phút sau đó đến cơ sở ý tế gần nhất.
d) Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc
- Giai đoạn 1: Sản xuất SO2:
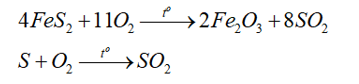
- Giai đoạn 2: Sản xuất SO3
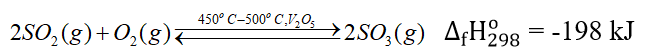
- Giai đoạn 3: Sản xuất H2SO4
2. Muối Sulfate
a) Ứng dụng của một số muối sulfate
- CaSO4 được dùng sản xuất vật liệu xây dựng; làm chất phụ gia để làm đông các sản phẩm như đậu hũ, đậu non,…
- BaSO4 được sử dụng làm phụ gia pha màu cho công nghiệp sơn, cho thủy tinh, cho gốm sứ cách điện và cao su chất lượng cao.
-MgSO4 được sử dụng làm muối tắm, làm dịu cơ bắp khi sưng tấy; bổ sung cho tôm, cá,…
-(NH4)2SO4: thành phần của thuốc trừ sau hòa tan, thuốc diệt nấm, phân bón,…
b) Nhận biết sulfate ion
- Thuốc thử để nhận biết ion sulfate là ion Ba2+.
Sơ đồ tư duy Sulfuric acid và muối sulfate
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: