Lời giải bài tập Hóa học lớp 11 Bài 4: Ammonia và một số hợp chất ammonium sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 4 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 4: Ammonia và một số hợp chất ammonium
Lời giải:
- Tính chất vật lí của ammonia: chất khí, không màu, mùi khai, xốc, nhẹ hơn không khí. Ammonia tan rất nhiều trong nước.
- Tính chất hoá học: Ammonia thể hiện tính khử và tính base trong các phản ứng hoá học.
Ví dụ:
+ Tính khử:
+ Tính base:
- Ứng dụng của ammonia: Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất.
1. Cấu tạo phân tử của ammonia
Lời giải:
- Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen.
- Do có thể tạo được liên kết hydrogen với nước nên ammonia tan rất nhiều trong nước.
- Trong phân tử NH3, nitrogen có số oxi hoá là -3, đây là số oxi hoá thấp nhất của nitrogen nên NH3 có tính khử khi tham gia phản ứng hoá học.
2. Tính chất của ammonia
Lời giải:
- Giải thích hiện tượng thí nghiệm:
+ Nước pha phenolphthalein sẽ bị hút lên bình chứa khí ammonia và phun thành tia do khí ammonia tan nhiều trong nước (ở điều kiện thường, 1 lít nước có thể hoà tan khoảng 800 lít khí ammonia) làm giảm áp suất trong bình và nước bị hút vào bình.
+ Nước phun thành tia màu hồng do dung dịch ammonia có tính base.
- Không thu khí ammonia bằng phương pháp đẩy nước do ammonia tan tốt trong nước.
Lời giải:
Từ kết quả trên ta thấy khí NH3 nhẹ hơn không khí nên có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình).
Lời giải:
NH3 + H2O ⇌ NH4+ + OH-
NH3 nhận proton (H+) nên đóng vai trò là base.
Do đó có thể nhận biết khí NH3 bằng giấy quỳ tím ẩm (hiện tượng: giấy quỳ tím ẩm chuyển sang màu xanh).
Lời giải:
- Hiện tượng: Có khói trắng xuất hiện.
- Phương pháp nhận biết ammonia bằng dung dịch HCl đặc: Mở nắp hai bình đựng hai dung dịch để cạnh nhau, nếu có khói trắng xuất hiện Þ bình hoá chất cần nhận biết là ammonia.
Phương trình hoá học: NH3 + HCl → NH4Cl.
Lời giải:
- Trong phản ứng với acid, ammonia thể hiện tính base:
- Trong phản ứng với oxygen, ammonia thể hiện tính khử:
3. Tổng hợp ammonia
Lời giải:
N2(g) + 3H2(g) 2NH3(g)
- < 0 phản ứng thuận toả nhiệt. Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 380 oC – 450 oC.
- Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí tức chiều thuận. Do đó phản ứng tổng hợp ammonia diễn ra ở áp suất cao, trong thực tế phản ứng này diễn ra ở 200 bar mà không thực hiện ở áp suất cao hơn. Điều này được giải thích như sau:
Khi thực hiện ở áp suất cao sẽ thu được nồng độ NH3 tại thời điểm cân bằng lớn, tuy nhiên khi tăng áp suất thì sự tăng nồng độ NH3 không tăng nhanh chỉ tăng chậm. Ngoài ra, khi tăng áp suất thì tiêu tốn năng lượng và yêu cầu thiết bị phải chịu được áp suất cao, do đó phải tính toán chính xác khi tăng áp suất để mang lại hiệu quả kinh tế cao nhất. Thực tế chứng minh quá trình sản xuất NH3 được thực hiện ở áp suất 150 – 200 bar đem lại hiệu quả cao nhất.
4. Muối ammonium
Lời giải:
- Muối ammonium là những chất tinh thể ion, không có màu.
- Muối ammonium đều được tạo bởi cation ammonium (NH4+) và anion gốc acid.
Lời giải:
- Hiện tượng: Có khí không màu, mùi khai thoát ra. Khí thoát ra làm xanh giấy màu ẩm.
- Giải thích: Dung dịch muối ammonium đậm đặc tác dụng với dung dịch base khi đun nóng tạo ra sản phẩm là khí ammonia. Khí ammonia làm xanh giấy quỳ tím ẩm.
NH4+ + OH- NH3↑ + H2O
- Các phương trình hoá học:
NH4Cl + NaOH NaCl + NH3↑ + H2O
NH4NO3 + NaOH NaNO3 + NH3↑ + H2O
(NH4)2SO4 + 2NaOH Na2SO4 + 2NH3↑ + 2H2O
Lời giải:
Đun nóng NH4Cl thấy có hiện tượng khói trắng trong ống nghiệm do NH4Cl bị phân huỷ tạo ra NH3(g) và HCl(g).
Phương trình hoá học minh hoạ:
NH4Cl(s) NH3(g) + HCl(g).
Lời giải:
Các phương trình hoá học:
(NH4)2CO3 + 2KOH → K2CO3 + 2NH3↑ + 2H2O
(NH4)2CO3 + 2HCl → 2NH4Cl + CO2↑ + H2O
(NH4)2CO3 + Ba(OH)2 → BaCO3↓ + 2NH3↑ + 2H2O
(NH4)2CO3 + CaCl2 → CaCO3↓ + 2NH4Cl.
Lời giải:
Do ở nhiệt độ cao NH4HCO3 bị phân huỷ tạo thành các khí NH3, CO2 và hơi nước. Các khí và hơi này thoát ra làm cho bánh xốp.
NH4HCO3 NH3↑ + CO2↑ + H2O.
Tuy nhiên việc sử dụng NH4HCO3 làm cho bánh có mùi khai, do đó hiện nay người ta thường ít sử dụng.
5. Ứng dụng
Lời giải:
Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất.
Lời giải:
Các loại phân bón như NH4Cl, NH4NO3, (NH4)2SO4 không thích hợp bón cho đất chua do ion NH4+ bị thuỷ phân sinh ra H+ làm tăng độ chua của đất.
NH4+ + H2O → NH3 + H3O+
Bài tập (trang 29)
Bài 1 trang 29 Hóa học 11: Liên kết hoá học trong phân tử NH3 là liên kết
A. cộng hoá trị phân cực.
B. ion.
C. cộng hoá trị không phân cực.
D. kim loại.
Lời giải:
Đáp án đúng là: A
0,4 < ∆? = 3,04 – 2,2 = 0,84 < 1,7.
Vậy liên kết trong phân tử NH3 là liên kết cộng hoá trị phân cực.
A. NH3.
B. H2.
C. NO2.
D. NO.
Lời giải:
Đáp án đúng là: A
Dung dịch muối ammonium tác dụng với dung dịch base khi đun nóng tạo ra sản phẩm là khí ammonia.
NH4+ + OH- NH3↑ + H2O
Lời giải:
Một số hoá chất để thực hiện quá trình trên: Ca(OH)2; O2…
Phương trình hoá học của các phản ứng xảy ra:
+ Chuyển ion ammonium thành ammonia:
NH4+ + OH- → NH3↑ + H2O
+ Chuyển ammonia thành nitrogen:
4NH3 + 3O2 2N2 + 6H2O.
Bài 4 trang 29 Hóa học 11: Cho cân bằng hoá học:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Cân bằng chuyển dịch theo chiều nào (có giải thích) khi:
a) tăng nhiệt độ.
b) tách ammonia ra khỏi hỗn hợp phản ứng.
c) giảm thể tích của hệ phản ứng.
Lời giải:
N2(g) + 3H2(g) ⇌ 2NH3(g)
a) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, tức chiều nghịch.
b) Khi tách ammonia ra khỏi hỗn hợp phản ứng cân bằng chuyển dịch theo chiều làm tăng ammonia, tức chiều thuận.
c) Khi giảm thể tích của hệ phản ứng tức tăng áp suất cân bằng chuyển dịch theo chiều làm giảm số mol khí, tức chiều thuận.
Lời giải:
Các phương trình hoá học xảy ra:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + 2H2O.
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O.
(NH4)2SO4 + BaCl2 → BaSO4↓ + 2NH4Cl.
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3.
Lý thuyết Ammonia và một số hợp chất ammonium
1. Cấu tạo của phân tử Ammonia
- Amoniac là một hợp chất vô cơ được cấu tạo từ 3 nguyên tử nitơ và 1 nguyên tử hidro tạo thành liên kết kém bền.
- Cấu tạo của phân tử Ammonia:
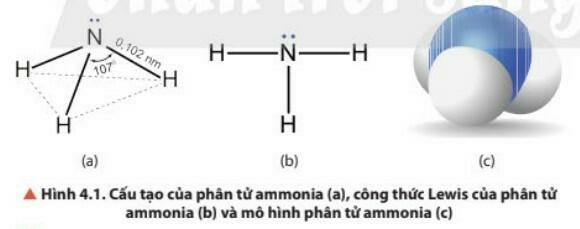
- NH3: có cấu trúc tóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen
2. Tính chất của Ammonia
a. Tìm hiểu tính chất vật lí của Ammonia
- Ammonia là chất khí không màu, có mùi khai, xốc và nhẹ hơn không khí
- Tan nhiều trong nước → dung dịch Ammonia có nồng độ 25%
b. Tìm hiểu tính chất hóa học của Ammonia
* Ammonia có tính khử và tính base:
- Ammonia tan trong nước tạo thành ion ammonium NH4+ và giải phóng ion OH-
NH3 + H2O ⇌ NH4+ + OH-
- Ammonia tác dụng với Acid (HCl, H2SO4) → muối ammonium
- Ammonia cháy trong khí oxy → nitrogen và hơi nước
- Khi có xúc tác Pt, ở nhiệt độ cao tạo thành NO và H2O
3. Tổng hợp Ammonia
Vận dụng kiến thức hóa học cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber
- Các bước của quá trình Haber:
+ Trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp, hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1:3) được nén ở áp suất cao và đưa vào tháp tổng hợp ammonia
+ Hỗn hợp khí đi ra từ tháp tổng hợp gồm N2, H2 và NH3 được dẫn đến tháp làm lạnh:
+ NH3 được hóa lỏng
+ Hỗn hợp khí N, và H, chưa phản ứng được đưa trở lại tháp tổng hợp.
Ví dụ: N2(g) + 3H2(g) ⇌ 2NH3(g)
4. Muối Ammonium
a. Tìm hiểu tính chất vật lí của Ammonium
- Muối ammonium được cấu tạo bởi cation ammonium
- Kí hiệu: NH4
+ Muối ammonium là những chất tinh thể ion
+ Dễ tan trong nước
b. Tìm hiểu tính chất hóa học của Ammonium
- Muối ammonium tác dụng với dung dịch kiềm khi đun nóng cho khí ammonia có mùi xốc đặc trưng. Phản ứng này dùng để nhận biết ion ammonium trong dung dịch.
Ví dụ: NH4+ + OH- → NH3↑ + H2O
- Muối ammonium dễ bị phân huỷ khi đun nóng.
5. Ứng dụng
a. Tìm hiểu ứng dụng của ammonia
- Sử dụng để sản xuất nitric acid, các loại phân đạm
- Chất làm lạnh, làm dung môi và nhiều ứng dụng khác
b. Tìm hiểu ứng dụng của ammonium
- Ammonium nitrate dùng làm phân bón
- Ammonium khác dùng làm phân đạm, phân bón, phức hợp
Sơ đồ tư duy Ammonia và một số hợp chất ammonium
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate