Lời giải bài tập Hóa học lớp 11 Bài 6: Sulfur và sulfur dioxide sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 6 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 6: Sulfur và sulfur dioxide
Lời giải:
- Tính chất cơ bản của sulfur:
+ Tính chất vật lí: sulfur là chất rắn, màu vàng, không tan trong nước, tan nhiều trong các dung môi hữu cơ như benzene, carbon disulfide...
+ Tính chất hoá học: khi tham gia phản ứng hoá học, sulfur có thể thể hiện tính oxi hoá hoặc tính khử. Trong thực tế, hầu hết các phản ứng của sulfur chỉ xảy ra khi đun nóng.
- Một số ứng dụng của sulfur:
+ Sản xuất diêm;
+ Sản xuất sulfuric acid;
+ Sản xuất thuốc trừ sâu;
+ Lưu hoá cao su…
1. Đơn chất sulfur
Lời giải:
Trong tự nhiên, sulfur tồn tại cả ở dạng đơn chất và hợp chất (quặng).
Một số quặng tự nhiên có chứa sulfur:
+ Quặng pyrite (thành phần chính là FeS2);
+ Quặng gypsum (thành phần chính là CaSO4.2H2O);
+ Quặng galena (thành phần chính là PbS);
+ Quặng barite (thành phần chính là BaSO4).
Lời giải:
Tính chất vật lí: sulfur là chất rắn, màu vàng, không tan trong nước, tan nhiều trong các dung môi hữu cơ như benzene, carbon disulfide...
Câu hỏi thảo luận 3 trang 36 Hóa học 11: Quan sát Hình 6.4, mô tả cấu tạo phân tử sulfur.
Lời giải:
Ở dạng phân tử, sulfur gồm 8 nguyên tử liên kết cộng hoá trị với nhau tạo thành mạch vòng.
Lời giải:
Hiện tượng: Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, tiếp theo hỗn hợp cháy sáng đỏ. Kết thúc phản ứng thu được hợp chất có màu đen. Phản ứng tỏa nhiều nhiệt.
Phương trình hoá học:
Vậy trong phản ứng này, Fe đóng vai trò là chất khử còn S đóng vai trò là chất oxi hoá.
Lời giải:
Hiện tượng: Sulfur cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong không khí mãnh liệt hơn.
Phương trình hoá học:
Chất khử: S; chất oxi hoá: O2.
Lời giải:
2Al + 3S Al2S3
Zn + S ZnS.
Lời giải:
Cách xử lí thuỷ ngân khi nhiệt kế thuỷ ngân không may bị vỡ:
- Dùng que bông ướt hoặc giấy mỏng thu gom thủy ngân lại, cho các hạt thủy ngân vào lọ thủy tinh bịt kín. Động tác khi thu gom thủy ngân phải hết sức nhẹ nhàng để tránh các hạt thủy ngân phân li thành các hạt nhỏ hơn, gây khó khăn cho việc thu dọn.
- Nếu có thể nên rắc một ít bột lưu huỳnh vì lưu huỳnh phản ứng với thủy ngân ngay điều kiện thường tạo thành hợp chất khó bốc hơi hơn.
Hg + S → HgS.
Lời giải:
Một số ứng dụng của sulfur đơn chất trong đời sống và sản xuất:
+ Sản xuất diêm;
+ Sản xuất sulfuric acid;
+ Sản xuất thuốc trừ sâu;
+ Lưu hoá cao su…
2. Sulfur dioxide
Lời giải:
- Phản ứng (1):
Trong phản ứng (1): SO2 đóng vai trò là chất khử; NO2 đóng vai trò là chất oxi hoá.
- Phản ứng (2):
Trong phản ứng (2): SO2 đóng vai trò là chất oxi hoá, H2S đóng vai trò là chất khử.
Lời giải:
- Một số nguồn phát thải sulfur dioxide:
+ Trong tự nhiên: núi lửa phun trào;
+ Tác động của con người: khí thải các phương tiện giao thông, đốt nhiên liệu hoá thạch …
- Tác hại: Sự phát thải khí SO2 vào bầu khí quyển là một trong những nguyên nhân chính gây nên hiện tượng mưa acid.
Câu hỏi thảo luận 9 trang 38 Hóa học 11: Giải thích sự hình thành mưa acid từ sulfur dioxide.
Lời giải:
Dưới xúc tác của các ion kim loại trong khói bụi SO2, bị oxi hoá, sau đó hoà tan trong nước mưa rơi xuống mặt đất, ao hồ … tạo thành hiện tượng mưa acid.
2SO2 + O2 + 2H2O 2H2SO4
Lời giải:
Một số biện pháp phù hợp với lứa tuổi học sinh giúp giảm thiểu lượng sulfur dioxide thải vào không khí:
- Sử dụng tiết kiệm nhiên liệu khi đun nấu …
- Tuyên truyền vận động mọi người sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường.
- Tuyên truyền vận động mọi người sử dụng các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió
Bài 1 trang 39 Hóa học 11: Tính chất nào sau đây không phải là tính chất vật lí của sulfur?
A. Màu vàng ở điều kiện thường.
B. Thể rắn ở điều kiện thường.
C. Không tan trong benzene.
D. Không tan trong nước.
Lời giải:
Đáp án đúng là: C
Sulfur tan được trong benzene.
Bài 2 trang 39 Hóa học 11: Số oxi hoá của sulfur trong phân tử SO2 là
A. +4.
B. -2.
C. +6.
D. 0.
Lời giải:
Đáp án đúng là: A
Trong SO2, số oxi hoá của oxygen là -2.
Gọi số oxi hoá của S là x, ta có: x + (-2).2 = 0 → x = +4.
Bài 3 trang 39 Hóa học 11: Cho các phản ứng sau:
a) S + O2 SO2.
b) Hg + S → HgS.
c) S + 6HNO3 → H2SO4 + 6NO2 + 2H2O.
d) Fe + S FeS.
Có bao nhiêu phản ứng trong đó sulfur đóng vai trò là chất khử?
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: B
Phản ứng trong đó sulfur đóng vai trò là chất khử là: (a); (c).
Lời giải:
50 lít không khí có 0,012 mg SO2.
1000 lít không khí có
Hay trong 1 m3 không khí này có 240 μg SO2.
Vậy không khí ở thành phố này chưa bị ô nhiễm.
Lý thuyết Sulfur và sulfur dioxide
1. Đơn chất Sulfur
a) Trạng thái tự nhiên:
- Trong tự nhiên, sulfur lắng đọng thành những mỏ lớn, nằm giữa lớp đá sâu hàng trăm mét.
- Khoáng vật trong tự nhiên chứa sulfur ở dạng hợp chất: quặng pyrite (FeS2), quặng gypsum (CaSO4.2H2O), quặng galena (PbS), quặng barite (BaSO4).
b) Cấu tạo, tính chất vật lý cơ bản của sulfur đơn chất
- Ở dạng phân tử, 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng. Kí hiệu là S.
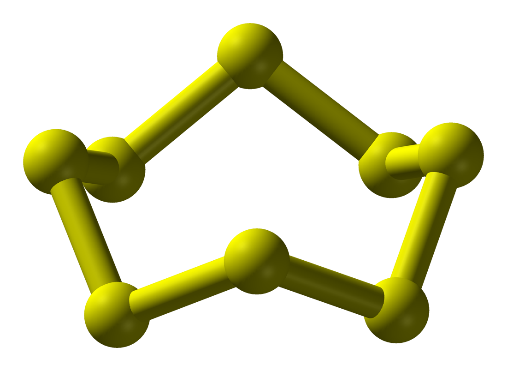
Hình 1: Phân tử sulfur ở điều kiện thường
-Ở điều kiện thường sulfur là: chất rắn, màu vàng, không tan trong nước, tan nhiều trong dung môi hữu cơ (benzine, carbon disulfide,…)
c) Tính chất hóa học
- Tính oxi hóa: sulfur oxi hóa được nhiều kim loại (trừ Au, Pt, Ag) ở nhiệt độ cao -> Muối sulfide
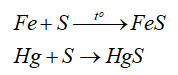
-Tính khử:
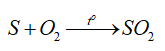
d) Ứng dụng
- Sulfur có nhiều ứng dụng như: điều chế H2SO4, lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,…
2. Sulfur dioxide
a) Tính chất hóa học và ứng dụng
- SO2 là chất khí không màu, mùi xốc, độc, nặng hơn không khí 2 lần, hóa lỏng ở -10℃ , tan nhiều trong nước.
- Tính khử: SO2 là chất khử khi tác dụng với chất oxi hóa mạnh (halogen, potassium permanganate, nitrogen dioxide,…)
-Tính oxi hóa: SO2 là chất oxi hóa khi tác dụng với chất khử mạnh (H2S, Mg, …)
-Sulfur dioxide được dùng để sản xuất sulfuric acid; tẩy trắng giấy; chống nấm mốc cho lương thực, thực phẩm,…
b) Sự hình thành sulfur dioxide, tác hại của sulfur dioxide và một số biện pháp giảm thiểu lượng sulfur dioxide thải vào không khí
- Sulfur dioxide được sinh ra trong tự nhiên và do tác động của con người

-Sulfur dioxide là một trong các chất chủ yếu gây ô nhiễm môi trường không khí và có hại cho sức khỏe của con người; sự phát thải SO2 vào bầu khí quyển cũng là một trong những nguyên nhân gây mưa acid.
-Một số biện pháp giảm lượng khí thải này:
+ Sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường thay cho nguồn năng lượng hóa thạch.
+ Khai thác các nguồn năng lượng tái tạo như: năng lượng mặt trời, năng lượng gió, mưa, sóng biển,…
+ Xử lí khí thải công nghiệp trước khi thải ra môi trường.
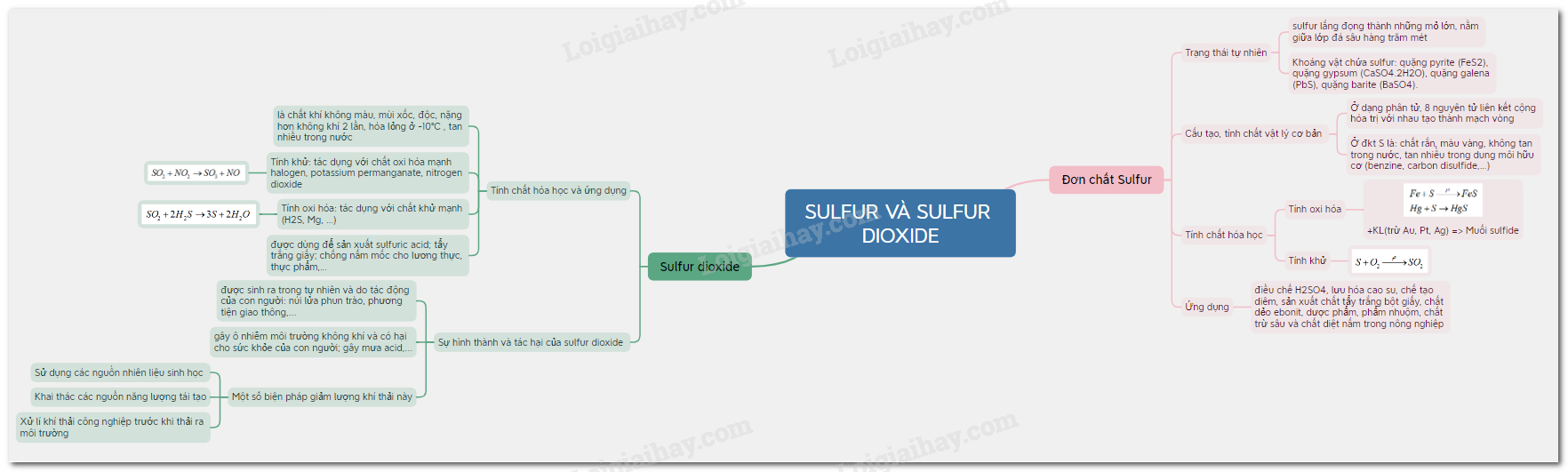
Sơ đồ tư duy Sulfur và Sulfur dioxide
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: