Với giải Luyện tập trang 15 Hóa học lớp 11 Chân trời sáng tạo chi tiết trong Bài 2: Cân bằng trong dung dịch nước giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 11. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 11 Bài 2: Cân bằng trong dung dịch nước
Luyện tập trang 15 Hóa học 11:
a) Pha 500 mL dung dịch HCl 0,2 M vào 500 mL nước. Tính pH của dung dịch thu được.
b) Tính khối lượng NaOH cần để pha 100 mL dung dịch NaOH có pH = 12.
Lời giải:
a) HCl → H+ + Cl-
nH+ = nHCl = 0,5.0,2 = 0,1 mol.
[H+] =
pH của dung dịch thu được: pH = -log[H+] = -log[0,1] = 1.
b) NaOH → Na+ + OH-
pH = 12 Þ [H+] = 10-12 M Þ [OH-] = 10-2 M.
nOH- = 10-2.0,1 = 10-3 (mol).
Khối lượng NaOH cần dùng là: mNaOH = 10-3.40 = 0,04 gam.
Lý thuyết Khái niệm pH chất chỉ thị Acid - base
a. Tìm hiểu khái niệm pH
- pH là chỉ số đánh giá độ acid hay base của một dung dịch
- Thang pH thường dùng có giá trị từ 1 đến 14
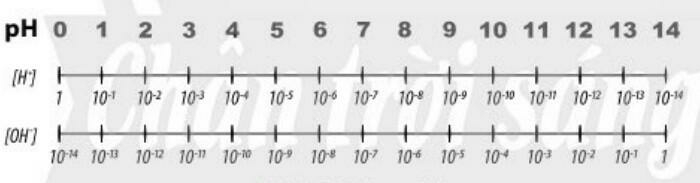
b. Tìm hiểu ý nghĩa của pH trong thực tiễn
- Chất chỉ thị acid - base là chất có màu sắc biến đổi theo giái trị pH của dung dịch

Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Luyện tập trang 14 Hóa học 11: Cho phương trình:...
Câu hỏi thảo luận 8 trang 15 Hóa học 11: Tính pH của dung dịch có nồng độ H+ là 10-2 M....
Câu hỏi thảo luận 9 trang 15 Hóa học 11: Tính pH của dung dịch có nồng độ OH- là 10-4 M....
Bài 4 trang 19 Hóa học 11: Viết phương trình điện li của các chất: H2SO4, Ba(OH)2, Al2(SO4)3....
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: