Với giải sách bài tập Hóa học 11 Bài 2: Cân bằng trong dung dịch nước sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 2: Cân bằng trong dung dịch nước
Bài 2.1 trang 11 SBT Hóa học 11: Vì sao dung dịch của các muối, acid, base dẫn điện?
A. Do có sự di chuyển của electron tạo thành dòng electron.
B. Do phân tử của chúng dẫn được điện.
C. Do các ion hợp phần có khả năng dẫn điện.
D. Do muối, acid, base có khả năng phân li ra ion trong dung dịch.
Lời giải:
Dung dịch của các muối, acid, base có khả năng phân li ra ion làm dung dịch dẫn điện.
→ Chọn D.
Bài 2.2 trang 11 SBT Hóa học 11: Dung dịch sodium chloride (NaCl) dẫn được điện là do
A. NaCl tan được trong nước.
B. NaCl điện li trong nước thành ion.
C. NaCl có vị mặn.
D. NaCl là phân tử phân cực.
Lời giải:
Dung dịch sodium chloride (NaCl) dẫn được điện là do NaCl điện li trong nước thành ion Na+ và Cl-.
→ Chọn B.
Bài 2.3 trang 11 SBT Hóa học 11: Saccharose là chất không điện li vì
A. phân tử saccharose không có khả năng hoà tan trong nước.
B. phân tử saccharose không có khả năng phân li thành ion trong nước.
C. phân tử saccharose không có tính dẫn điện.
D. phân tử saccharose có khả năng hoà tan trong nước.
Lời giải:
Saccharose là chất không điện li vì phân tử saccharose không có khả năng phân li thành ion trong nước.
→ Chọn B.
Bài 2.4 trang 11 SBT Hóa học 11: Phát biểu nào sau đây đúng khi nói về sự điện li?
A. Sự điện li là quá trình phân li một chất trong nước thành ion.
B. Sự điện li quá trình hoà tan một chất vào nước tạo thành dung dịch.
C. Sự điện li là quá trình phân li một chất dưới tác dụng của dòng điện.
D. Sự điện li thực chất là quá trình oxi hoá – khử.
Lời giải:
Sự điện li là quá trình phân li một chất trong nước thành ion.
→ Chọn A.
Bài 2.5 trang 11 SBT Hóa học 11: Các chất trong dãy nào sau đây là những chất điện li mạnh?
A. HCl, NaOH, CH3COOH.
B. KOH, NaCl, H3PO4.
C. HCl, NaOH, NaCl.
D. NaNO3, NaNO2, NH3.
Lời giải:
Chất điện li mạnh bao gồm acid mạnh, base mạnh và hầu hết các muối tan: HCl, NaOH, NaCl.
→ Chọn C.
Bài 2.6 trang 12 SBT Hóa học 11: Phương trình diện là nào sau đây biểu diễn không đúng?
A.
B.
C.
D.
Lời giải:
HF (acid yếu) là chất điện li yếu, do dó phương trình điện li của HF phải được biểu diễn bằng hai nửa mũi tên ngược chiều nhau:
→ Chọn A.
Bài 2.7 trang 12 SBT Hóa học 11: Phương trình điện li nào sau đây biểu diễn đúng?
A.
B.
C.
D.
Lời giải:
|
Chất điện li |
Độ điện li |
Phương trình điện li |
|
NaOH (base mạnh) |
Mạnh |
|
|
HClO (acid yếu) |
Yếu |
|
|
Al2(SO4)3 (muối tan) |
Mạnh |
|
|
NH4Cl (muối tan) |
Mạnh |
|
→ Chọn C.
A. bình định mức.
B. burette.
C. pipette.
D. ống đong.
Lời giải:
Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong (1) burette vào dung dịch đựng trong bình tam giác.
→ Chọn B.
Lời giải:
Chất điện li gồm acid, base và muối tan.
→ Chất điện li: NaCl, KOH, Ba(OH)2, AlCl3, CuSO4, H2SO4.
Lời giải:
Bài 2.11 trang 12 SBT Hóa học 11: Tính nồng độ mol của các ion trong các dung dịch sau:
a) Ba(NO3)2 0,1 M.
b) HNO3 0,02 M.
c) КОН 0,01 М.
Lời giải:
a)
b)
c)
Lời giải:
Nước vôi trong hấp thụ CO2 trong không khí tạo CaCO3 và H2O (CaCO3 là chất không điện li, H2O là chất điện li yếu), làm giảm nồng độ Ca(OH)2 nên khả năng dẫn điện của nước vôi trong.
Lời giải:
Nước đóng vai trò là acid (nước cho H+): (b), (d).
Nước đóng vai trò là base (nước nhận H+): (a), (c).
Bài 2.14 trang 12 SBT Hóa học 11: Cho các phân tử và ion sau:
. Hãy cho biết phân tử, ion nào là acid, base, lưỡng tính theo thuyết Brønsted – Lowry. Giải thích.
Lời giải:
|
Phương trình |
Phân loại chất |
|
|
HI là chất cho proton → HI là acid. |
|
|
là chất nhận proton → là base. |
|
|
có thể cho hoặc nhận proton → là chất lưỡng tính |
|
|
là chất nhận proton → là base. |
|
|
NH3 là chất nhận proton → NH3 là base. |
|
|
S2- là chất nhận proton → S2- là base. |
|
|
có thể cho hoặc nhận proton → là chất lưỡng tính |
Bài 2.15 trang 13 SBT Hóa học 11: a) Tính pH của dung dịch có nồng độ ion H+ là 4,2×10-10 M
b) Tính nồng độ mol của ion H+ trong dung dịch có pH = 6,35.
c) Tính pH của dung dịch có nồng độ ion OH- là 4,0×10-11 M.
Lời giải:
a) [H+] = 4,2×10-10 (M)
=> pH = -lg(4,2×10-10) = 9,38
b)
c)
Lời giải:
Gọi a (L) là thể tích nước cần pha.
Ta có:
Với
Mặt khác:
Cách pha: Đong 90 mL nước cất rồi cho vào bình đựng 10 mL dung dịch HCl có pH = 3, dùng đũa thủy tinh khuấy đều dung dịch. Ta thu được 100 mL dung dịch HCl có pH = 4.
Lời giải:
Người ta không sử dụng dung dịch acid HNO3 trong phương pháp chuẩn độ acid – base vì:
+ Acid HNO3 không bền, khi có ánh sáng dễ bị phân hủy, làm sai lệch nồng độ HNO3 ban đầu, dẫn tới sai lệch kết quả phân tích khi chuẩn độ.
+ Khi phản ứng với base, HNO3 có thể oxi hóa một số ion kim loại tạo thành các sản phẩm phức tạp khó xác định, gây ảnh hưởng đến độ chính xác của phép chuẩn độ.
Lời giải:
Bảo toàn nguyên tố H, ta có:
Gọi V là thể tích dung dịch B, ta có:
Dung dịch sau phản ứng có
=> H+ dư, OH- hết.
Phương trình:
0,49V ← 0,49V
Mặt khác:
Lời giải:
VHCl = 40 (mL); CNaOH = 0,12 (M); VNaOH = 34 (mL)
Lời giải:
|
VNaOH (mL) |
Giá trị pH |
VNaOH (mL) |
Giá trị pH |
|
0,0 |
1,00 |
25,1 |
10,30 |
|
5,0 |
1,18 |
25,5 |
11,00 |
|
10,0 |
1,37 |
26,0 |
11,29 |
|
15,0 |
1,60 |
28,0 |
11,75 |
|
20,0 |
1,95 |
30,0 |
11,96 |
|
22,0 |
2,20 |
35,0 |
12,22 |
|
24,0 |
2,69 |
40,0 |
12,36 |
|
24,5 |
3,00 |
45,0 |
12,46 |
|
24,9 |
3,70 |
50,0 |
12,52 |
|
25,0 |
7,00 |
|
|
Lời giải:
- Đồ thị biểu diễn sự biến thiên pH của dung dịch trong quá trình chuẩn độ dung dịch HCl bằng dung dịch chuẩn NaOH 0,100 M:
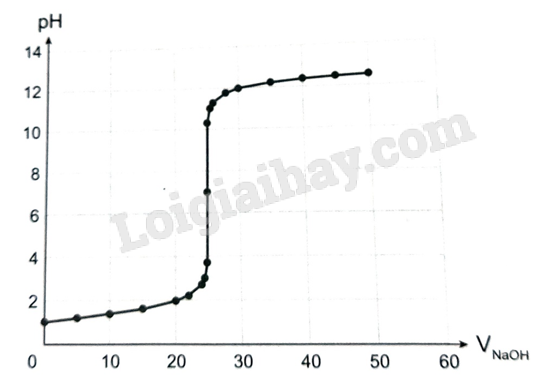
- Chuẩn độ HCl (acid mạnh) bằng NaOH (base mạnh):
+ Tại điểm tương đương, [H+] = [OH-]; pH = 7.
+ Bước nhảy chuẩn độ: ở khoảng pH từ 3,7 đến 10,3.
Xem thêm các bài giải SBT Hóa học lớp 11 Chân trời sáng tạo hay, chi tiết khác:
Bài 1: Khái niệm về cân bằng hóa học
Bài 2: Cân bằng trong dung dịch nước
Bài 4: Ammonia và một số hợp chất ammonium
Lý thuyết Cân bằng trong dung dịch nước
1. Sự điện li, chất điện li, chất không điện li
a. Tìm hiểu hiện tượng điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành các ion.
Ví dụ:
NaCl → Na+ + Cl-
NaOH → Na+ + OH-
HCl → H+ + Cl-
b. Tìm hiểu sự phân loại các chất điện li
- Chất điện li mạnh: Là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion
Ví dụ: Axit HCl, HNO3, Bazo mạnh (NaOH, KOH),…
- Chất điện li yếu: Là chất khi tan trong nước, chỉ có một số phân tự hòa tan thành ion, còn lại vẫn tồn tạo ở dạng phân tử
Ví dụ: Axit hữu cơ CH3COOH, axit HClO, H2S, HE,…
- Chất không điện li: Là chất khi hòa tan trong nước, các phân tử không phân li thành ion.
2. Thuyết Brønsted–Lowry về acid–base
- Acid là chất proton (H+)
- Base là chất nhận proton
=> Acid và base có thể là phân tử hoặc ion
CH3COOH + H2O ⇌ CH3COO– + H3O+
3. Khái niệm pH chất chỉ thị Acid - base
a. Tìm hiểu khái niệm pH
- pH là chỉ số đánh giá độ acid hay base của một dung dịch
- Thang pH thường dùng có giá trị từ 1 đến 14
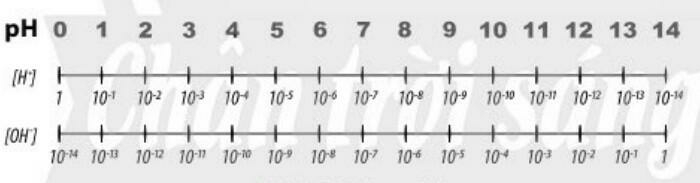
b. Tìm hiểu ý nghĩa của pH trong thực tiễn
- Chất chỉ thị acid - base là chất có màu sắc biến đổi theo giái trị pH của dung dịch

4. Chuẩn độ Acid - Base
- Để xác định nồng độ dung dịch acid hoặc base chưa biết người ta dùng dung dịch acid hoặc base (kiềm) đã biết chính xác nồng độ.
5. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+, CO32-
a. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+
- Ion Al3+, Fe3+, dễ bị phân hủy trong nước tạo thành base không tan và cho môi trường acid.
b. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion CO32-
CO32- +H2O ⇌ HCO3- + HO-
- Ion CO32- bị phân hủy cho môi trường base