Lời giải bài tập Hóa học lớp 11 Bài 15: Dẫn xuất halogen sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 15 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 15: Dẫn xuất halogen
Halothane là dẫn xuất halogen của hydrocarbon, có tính chất đặc trưng và ứng dụng thực tiễn. Dẫn xuất halogen của hydrocarbon là gì? Có những tính chất và ứng dụng trong lĩnh vực nào?
Lời giải:
- Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng một hay nhiều nguyên tử halogen, ta được dẫn xuất halogen của hydrocarbon.
- Tính chất vật lý của dẫn xuất halogen: nhiệt độ sôi của các dẫn xuất halogen có xu hướng tăng dần theo chiều tăng khối lượng phân tử; dẫn xuất halogen không tan trong nước nhưng tan trong các dung môi hữu cơ như alcohol, ether, benzene.
- Tính chất hoá học: Các dẫn xuất halogenoalkane có thể bị tách hydrogen halide để tạo thành alkene. Trường hợp có nhiều alkene được tạo thành thì sản phẩm chính được xác định theo quy tắc Zaitsev.
- Dẫn xuất halogen được ứng dụng trong nhiều lĩnh vực như: làm dung môi hữu cơ, sản xuất các loại thuốc bảo vệ thực vật, thuốc tăng trưởng thực vật, chất dẻo, sử dụng trong công nghiệp nhiệt lạnh…
1. Khái niệm
Lời giải:
Thành phần các nguyên tố trong dẫn xuất halogen của hydrocarbon nhất định phải có carbon, halogen, có thể có hydrogen.
Lời giải:
Chất là dẫn xuất halogen của hydrocarbon: CH3Br, F2C=CF2, CH2Cl2.
2. Đồng phân và danh pháp
Lời giải:
- Cách đánh số thứ tự mạch carbon trong dẫn xuất halogen:
+ Nếu dẫn xuất halogen không có liên kết bội: Đánh số thứ tự chỉ vị trí nguyên tử carbon mạch chính sao cho tổng số chỉ của các nhóm thế là nhỏ nhất. Trong trường hợp tổng số chỉ vị trí của các nhóm thế bằng nhau thì đánh số carbon ở mạch chính ưu tiên từ phía gần nguyên tử halogen.
+ Nếu dẫn xuất halogen có liên kết bội (không no): Ưu tiên đánh số từ phía đầu mạch gần liên kết bội hơn.
- Đồng phân cấu tạo của các dẫn xuất halogen gồm: đồng phân mạch carbon; đồng phân vị trí liên kết đôi, liên kết ba và đồng phân vị trí nguyên tử halogen.
Lời giải:
CH3–CH2–CH2Cl: 1 – chloropropane.
CH3–CHCl–CH3: 2 – chloropropane.
3. Tính chất vật lí
Lời giải:
Nhiệt độ sôi của các dẫn xuất halogen tăng theo chiều tăng độ dài mạch carbon (cùng loại halogen) và tăng theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I (cùng gốc alkyl).
4. Tính chất hóa học
Lời giải:
Ống nghiệm (2) chứa dichloromethane, do dichloromethane hầu như không tan trong nước nên dung dịch bị phân lớp.
Lời giải:
Cần rửa ion Br- để không làm sai lệch kết quả thí nghiệm.
Lời giải:
Cần acid hoá dung dịch sau khi thuỷ phân bằng dung dịch HNO3 trước khi cho dung dịch AgNO3 để tránh sinh ra kết tủa Ag2O làm sai lệch kết quả thí nghiệm. Cụ thể, nếu còn base dư có thêm phản ứng:
AgNO3 + NaOH → AgOH + NaNO3
2AgOH (không bền) → Ag2O + H2O.
Không thể thay thế dung dịch HNO3 bằng các dung dịch H2SO4 hay HCl vì các acid này đều tạo kết tủa với AgNO3, làm sai lệch kết quả thí nghiệm.
Câu hỏi thảo luận 6 trang 95 Hóa học 11: Giải thích kết quả của thí nghiệm ở Bước 4.
Lời giải:
Phản ứng thuỷ phân bromoethane bằng dung dịch NaOH thu được ethanol và sodium bromide:
NaBr sinh ra, phản ứng với AgNO3 thu được kết tủa vàng nhạt (AgBr) theo phương trình hoá học:
NaBr + AgNO3 → AgBr↓ + NaNO3
Lời giải:
Trong phản ứng tách hydrogen halide, nguyên tử hydrogen ở nguyên tử carbon bên cạnh được tách cùng với nguyên tử halogen ra khỏi dẫn xuất.
Trong đó, nguyên tử halogen ưu tiên tách ra cùng với nguyên tử hydrogen ở nguyên tử carbon bên cạnh có bậc cao hơn, tạo ra sản phẩm chính.
Luyện tập trang 96 Hóa học 11: Hoàn thành các phương trình hoá học:
a) CH3Cl + KOH →
b) CH3CH2Br + NaOH →
c) CH2 = CHCH2Cl + NaOH →
d) CH3CH2Br
e)
Lời giải:
a) CH3Cl + KOH → CH3OH + KCl;
b) CH3CH2Br + NaOH → CH3CH2OH + NaBr;
c) CH2 = CHCH2Cl + NaOH → CH2 = CHCH2OH + NaCl;
d) CH3CH2Br CH2 = CH2 + HBr;
e)
5. Ứng dụng
Lời giải:
Hướng giải quyết:
- Cần có chế tài xử phạt nghiêm khắc đối với các hành vi lạm dụng thuốc bảo vệ thực vật, thuốc kích thích tăng trưởng trong sản xuất nông nghiệp.
- Tuyên truyền bà con nông dân sử dụng các chế phẩm sinh học trong sản xuất nông nghiệp.
- Xây dựng các mô hình nông nghiệp xanh hướng đến không sử dụng thuốc bảo vệ thực vật, thuốc kích thích tăng trưởng …
Bài tập (trang 98)
Bài 1 trang 98 Hóa học 11: Gọi tên các dẫn xuất halogen:
Lời giải:
Tên gọi các dẫn xuất halogen:
(1) 1 – chloropropane.
(2) 1 – iodoethylene.
(3) 1,3 – dichloropropane.
(4) 1 – chloro – 2 – methylpropane.
(5) bromobenzene.
Bài 2 trang 98 Hóa học 11: Cho sơ đồ biến đổi của 1 – chloropropane như sau:
CH3CH=CH2 CH3CH2CH2Cl CH3CH2CH2OH
a) Gọi tên loại phản ứng (1), (2) và hoàn thành các phương trình hoá học.
b) Thực hiện 2 phản ứng theo sơ đồ trên khi thay hợp chất CH3CH2CH2Cl bằng 2 – bromobutane. Xác định sản phẩm hữu cơ chính (nếu có) trong các phản ứng.
Lời giải:
a) Phản ứng (1): phản ứng tách hydrogen halide
CH3CH2CH2Cl CH3CH=CH2 + HCl
Phản ứng (2): phản ứng thế nguyên tử halogen bằng nhóm OH
CH3CH2CH2Cl + NaOH → CH3CH2CH2OH + NaCl
b)
CH3 – CHBr – CH2 – CH3 + NaOH → CH3 – CH(OH) – CH2 – CH3 + NaBr.
Lời giải:
Ngày nay các dẫn xuất halogen chứa chlorine (CFC) được thay thế bằng các dẫn xuất hydrofluorocarbon (HFC) và hydrofluoroether (HFE) để tránh việc phá huỷ tầng ozone.
Lý thuyết Dẫn xuất halogen
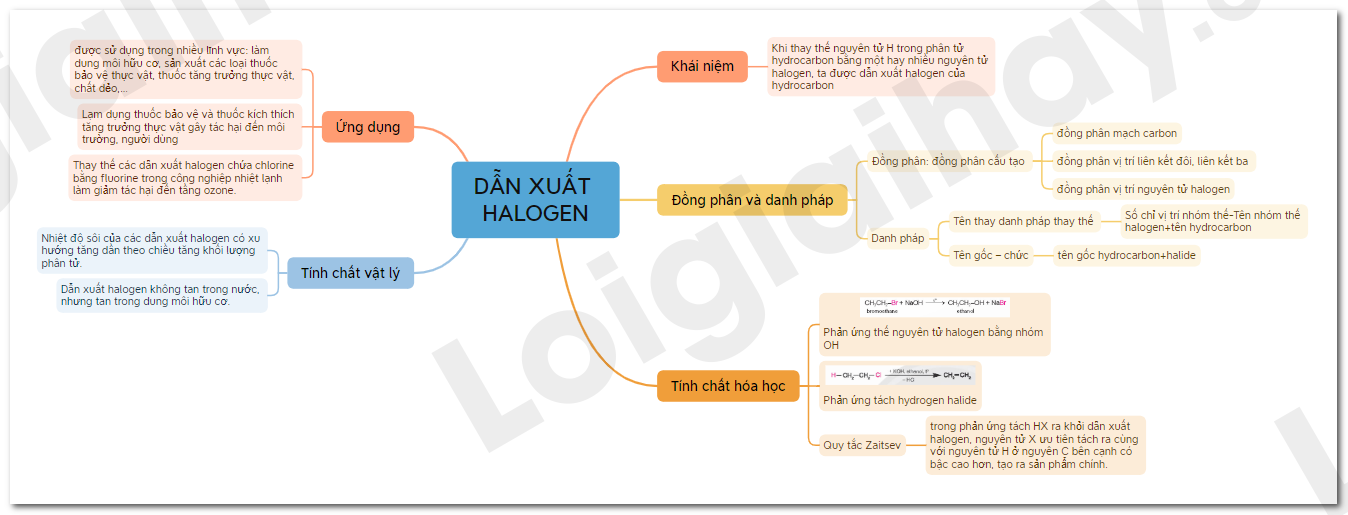
1. Khái niệm
- Khi thay thế nguyên tử H trong phân tử hydrocarbon bằng một hay nhiều nguyên tử halogen, ta được dẫn xuất halogen của hydrocarbon.
2. Đồng phân và danh pháp
- Đồng phân cấu tạo của dẫn xuất halogen gồm có: đồng phân mạch carbon, đồng phân vị trí liên kết đôi, liên kết ba và đồng phân vị trí nguyên tử halogen.
- Tên thay danh pháp thay thế của dẫn xuất halogen:
Số chỉ vị trí nhóm thế - Tên nhóm thế halogen+tên hydrocarbon
-Tên gốc – chức: tên gốc hydrocarbon+halide
3. Tính chất vật lý
- Nhiệt độ sôi của các dẫn xuất halogen có xu hướng tăng dần theo chiều tăng khối lượng phân tử.
- Dẫn xuất halogen không tan trong nước, nhưng tan trong dung môi hữu cơ như alcohol, ether, benzene.
4. Tính chất hóa học
a) Phản ứng thế nguyên tử halogen bằng nhóm OH
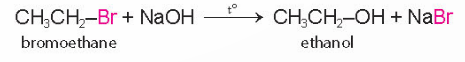
- Dẫn xuất halogen mà nguyên tử halogen lien kết với nguyên tử carbon no có phản ứng thế nhóm –OH trong dung dịch kiếm, đun nóng.
b) Phản ứng tách hydrogen halide
- Các dẫn xuất halogenoalkane có thể bị tách hydrogen halide để tạo thành alkene.
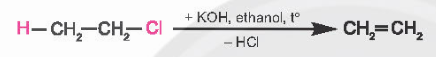
- Quy tắc Zaitsev: trong phản ứng tách HX ra khỏi dẫn xuất halogen, nguyên tử X ưu tiên tách ra cùng với nguyên tử H ở nguyên C bên cạnh có bậc cao hơn, tạo ra sản phẩm chính.
5. Ứng dụng
- Dẫn xuất halogen được sử dụng trong nhiều lĩnh vực: làm dung môi hữu cơ, sản xuất các loại thuốc bảo vệ thực vật, thuốc tăng trưởng thực vật, chất dẻo,…
- Lạm dụng thuốc bảo vệ và thuốc kích thích tăng trưởng thực vật gây tác hại nghiêm trọng đến sức khỏe người tiêu dùng.
- Thay thế các dẫn xuất halogen chứa chlorine bằng fluorine trong công nghiệp nhiệt lạnh làm giảm tác hại đến tầng ozone.
Sơ đồ tư duy Dẫn xuất halogen
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: