Lời giải bài tập Hóa học lớp 11 Bài 14: Arene (Hydrocarbon thơm) sách Chân trời sáng tạo hay, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 11 Bài 14 từ đó học tốt môn Hóa 11.
Giải bài tập Hóa học lớp 11 Bài 14: Arene (Hydrocarbon thơm)
Lời giải:
- Arene là những hydrocarbon có chứa vòng benzene trong phân tử.
- Cấu tạo arene: Có vòng benzene.
- Tính chất vật lí: Các arene đều độc, không tan trong nước, tan nhiều trong dung môi hữu cơ. Một số arene có mùi đặc trưng.
- Tính chất hoá học: Arene có thể tham gia phản ứng thế, phản ứng cộng, phản ứng nitro hoá, phản ứng oxi hoá …
- Ứng dụng: Benzene, toluene, xylene là các nguyên liệu rất quan trọng. Toluene còn là dung môi và là chất trung gian trong quá trình sản xuất các loại hoá chất khác; p – xylene là nguyên liệu sản xuất tơ polyester; benzene dùng trong sản xuất phẩm nhuộm, dược phẩm, chất tẩy rửa …
1. Khái niệm về arene
Lời giải:
- Cấu tạo của benzene: Sáu nguyên tử carbon trong phân tử benzene nằm ở sáu đỉnh của một hình lục giác đều. Mỗi nguyên tử carbon liên kết với một nguyên tử hydrogen, toàn bộ phân tử nằm trên một mặt phẳng, các góc liên kết đều bằng 120o, độ dài liên kết carbon – carbon đều bằng 139 ppm.
- Điểm khác của benzene so với các hydrocarbon khác đã học: các nguyên tử carbon trong benzene tạo thành vòng 6 cạnh.
2. Tính chất vật lí
Lời giải:
Dữ kiện cho thấy naphthalene ở thể rắn trong điều kiện thường là: nhiệt độ sôi 218 oC.
3. Tính chất hóa học
Lời giải:
Hiện tượng: tạo ra chất lỏng màu vàng, sánh như dầu.
Lời giải:
- Hiện tượng:
+ Ở nhánh chứa KMnO4 và HCl sinh ra khí màu vàng lục.
+ Khí màu vàng lục khuếch tán sang nhánh thứ nhất, thấy trong nhánh thứ nhất xuất hiện khói trắng và trên thành ống nghiệm thấy xuất hiện một lớp bột màu trắng.
- Giải thích:
KMnO4 phản ứng với HCl sinh ra chlorine.
Sau đó, benzene phản ứng với chlorine (điều kiện: ánh sáng), tạo thành lớp bột màu trắng là 1,2,3,4,5,6 – hexachlorocyclohexane (C6H6Cl6). Phản ứng này là phản ứng cộng, theo phương trình hoá học sau:
Lời giải:
Vai trò của KMnO4 và HCl là để điều chế chlorine:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Lời giải:
Phản ứng cộng hydrogen vào vòng benzene xảy ra ở các liên kết pi (ℼ).
Lời giải:
Benzene và toluene đều không tác dụng với KMnO4 ở điều kiện thường. Khi đun nóng nhẹ hay ngâm vào nước nóng, toluene tác dụng được với dung dịch KMnO4 trong môi trường acid theo phương trình hoá học:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O.
4. Ứng dụng và điều chế arene trong công nghiệp
Lời giải:
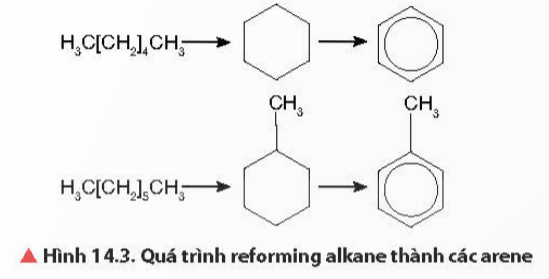
H3C[CH2]4CH3 
H3C[CH2]5CH3 
Lời giải:
HS tự thiết kế poster theo các gợi ý sau:
- Ứng dụng của arene trong đời sống: Benzene, toluene, xylene là các nguyên liệu rất quan trọng. Toluene còn là dung môi và là chất trung gian trong quá trình sản xuất các loại hoá chất khác; p – xylene là nguyên liệu sản xuất tơ polyester; benzene dùng trong sản xuất phẩm nhuộm, dược phẩm, chất tẩy rửa …
- Tác hại của arene: độc, gây hại cho sức khoẻ nếu tiếp xúc trong một khoảng thời gian dài.
- Mục đích của việc thêm benzene và một số arene khác vào xăng: giúp tăng chỉ số octane của xăng, nhờ đó nhiên liệu được đốt cháy hiệu quả hơn.
Bài tập (trang 91)
a) Viết công thức cấu tạo và gọi tên các xylene.
b) Trình bày phương pháp hoá học phân biệt benzene và xylene.
Lời giải:
a) Công thức cấu tạo và tên gọi các xylene:
b) Phương pháp hoá học phân biệt benzene và xylene: dùng dung dịch KMnO4 trong môi trường acid. Hiện tượng:
+ Benzene không tác dụng với dung dịch KMnO4 trong môi trường acid ở điều kiện thường hoặc kể cả khi đun nóng.
+ Xylene không tác dụng với dung dịch KMnO4 trong môi trường acid ở điều kiện thường nhưng tác dụng được khi đun nóng (làm mất màu thuốc tím khi đun nóng).
Bài 2 trang 91 Hóa học 11: Hoàn thành phương trình hoá học của các phản ứng theo sơ đồ:
Lời giải:
Các phương trình hoá học minh hoạ sơ đồ:
a)
(1) C6H6 + Cl2 C6H5Cl + HCl
(2) C6H6 + HNO3 C6H5NO2 + H2O
b)
CH3[CH2]5CH3 C6H5CH3 + H2
Lý thuyết Arene (Hydrocarbon thơm)
1. Khái niệm về arene
- Arene là những hydrocarbon có chứa vòng benzene trong phân tử.
2. Tính chất vật lý
- Các arene hầu như không tan trong nước, tan nhiều trong dung môi hữu cơ như acetone, diethyl ether,…
- Các arene đều độc, một số arene có mùi đặc trưng.
3. Tính chất hóa học
a) Phản ứng thế của benzene và toluene
- Phản ứng halogen hóa
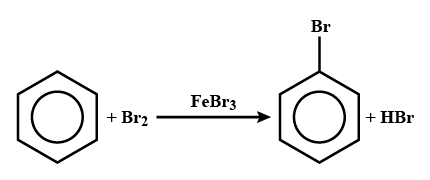
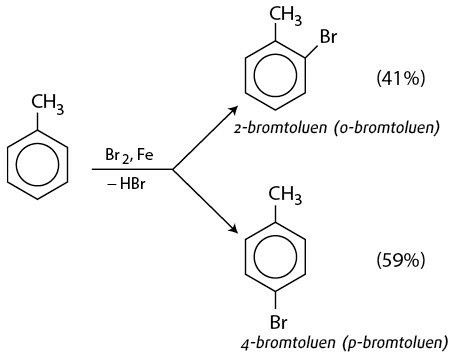
Khi có FeCl3 hoặc FeBr3 làm xúc tác, benzene tham gia phản ứng thể nguyên tử hydrogen của vòng benzene với bromine khan tạo thành bromobenzene, còn toluene tạo sản phẩm chính là hỗn hợp o-bromotoluene và p-bromotoluene.
- Phản ứng nitro hóa benzene và toluene
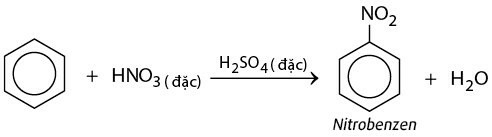
Khi tác dụng với dung dịch hỗn hợp HNO3 đặc và H2SO4 đặc, benzene tham gia phản ứng nitro hóa tạo thành nitrobenzene, còn toluene phản ứng dễ dàng hơn và ưu tiên thế vào các vị trí ortho và para.
- Khi vòng benzene có gắn nhóm thế alkyl (-CH3;-C2H5,…) các phản ứng thế nguyên tử H ở vòng benzene xảy ra dễ dàng hơn so với benzene và ưu tiên thế vào vị trí ortho hoặc para so với nhóm alkyl.
b) Phản ứng cộng vào vòng benzene
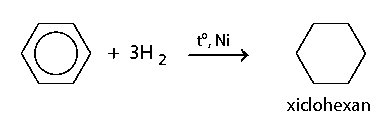
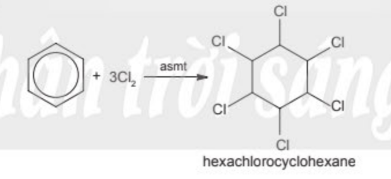
c) Phản ứng oxi hóa
- Các alkylbenzene có thể bị oxi hóa bởi dung dịch KMnO4 khi đun nóng.
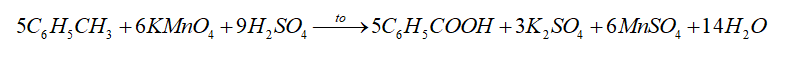
- Các arene cháy trong không khí tỏa nhiều nhiệt:
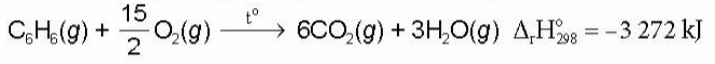
4. Ứng dụng và điều chế arene trong công nghiệp
a) Ứng dụng
- Trong ngành lọc hóa dầu, benzene, toluene và xylene (o-,m-,p-) được gọi chung là nhóm BTX là nguyên liệu rất quan trọng.
- Toluene là dung môi và chất trung gian trong quá trình sản xuất các loại hóa chất khác.
- p-xylene là nguyên liệu sản xuất tơ polyester.
- Benzene dùng trong sản xuất phẩm nhuộm.
b) Điều chế
- Arene hầu hết đều được điều chế từ dầu mỏ qua quá trình reforming.
Sơ đồ tư duy Arene
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: