Với giải Câu hỏi 2 trang 98 Hóa học lớp 12 Cánh diều chi tiết trong Bài 14: Tính chất hoá học của kim loại giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 14: Tính chất hoá học của kim loại
Câu hỏi 2 trang 98 Hóa học 12: Dựa vào thế điện cực chuẩn của kim loại trong Bảng 10.1, giải thích vì sao Cu và Ag không phản ứng với dung dịch hydrochloric acid 1 M.
Lời giải:
Có = 0 V mà = 0,34 V > 0 V; = 0,799 V > 0 V nên Cu, Ag không khử được ion H+ trong dung dịch hydrochloric acid.
Do đó Cu và Ag không phản ứng với dung dịch hydrochloric acid 1 M.
Lý thuyết Tác dụng với dung dịch acid
1. Tác dụng với dung dịch hydrochloric acid, dung dịch sulfuric acid loãng
Do nên kim loại M có giá trị thế điện cực chuẩn có theẻ khử được ion H+ trong dung dịch hydrchloric acid hoặc dung dihcj sulfuric acid loãng, tạo thành khí H2
Ví dụ: Zn(s) + 2H+(aq) Zn2+ (aq) + H2(g)
Do giá trị thế điện cực chuẩn dương nên các kim loại như Cu, Ag,… không tác dụng với dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng.
2. Tác dụng với dung dịch sulfuric acid đặc
Hầu hết các kim loại (trừ Au và Pt) phản ứng được với dung dịch sulfuric acid đặc. Phản ứng này thường tạo thành muối sulfate, nước và sulfur dioxide. Phản ứng diễn ra mạnh hơn khi hỗn hợp phản ứng được đun nóng
Ví dụ: 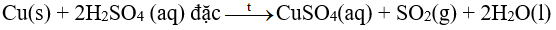
Xem thêm lời giải bài tập Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Thí nghiệm 1 trang 96 Hóa học 12: Kim loại tác dụng với oxygen trong không khí...
Luyện tập 2 trang 97 Hóa học 12: Cho = −2,925 V, = 0,854 V....
Thí nghiệm 2 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch muối...
Thí nghiệm 3 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch hydrochloric acid...
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 13. Cấu tạo và tính chất vật lí của kim loại
Bài 14. Tính chất hoá học của kim loại
Bài 15. Tách kim loại và tái chế kim loại