Lời giải bài tập Hóa học lớp 12 Bài 18: Nguyên tố nhóm IIA sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 18: Nguyên tố nhóm IIA
Hình 18.1. Một số ứng dụng của hợp chất của nguyên tố nhóm IIA
a) Nêu một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IIA mà em biết.
b) Kim loại nhóm IIA có những tính chất vật lí và tính chất hoá học nào?
Lời giải:
a) Một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IIA mà em biết:
- Mg: tham gia tạo hợp kim.
- Ba: làm chất cản quang trong y tế.
- Be: làm vật liệu sản xuất tên lửa, tàu vũ trụ.
- CaCO3 (đá vôi): sản xuất vôi sống, xi măng.
- CaO (vôi sống): khử chua, tẩy uế, hút ẩm, vật liệu xây dựng, …
…
b) Kim loại nhóm IIA có những tính chất vật lí: nhẹ, khối lượng riêng nhỏ, nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA nhưng tương đối thấp so với các kim loại khác.
Kim loại nhóm IIA có tính chất hóa học: Tính khử: M ⟶ M2+ + 2e. Tác dụng với các chất oxi hóa như phi kim (O2, Cl2, …), H2O, acid, …
Lời giải:
Trong cùng chu kì, kim loại nhóm IIA có tính khử yếu hơn so với tính khử của kim loại nhóm IA.
Vì trong cùng một chu kì, từ nhóm IA sang nhóm IIA điện tích hạt nhân tăng, bán kính nguyên tử giảm làm lực hút electron lớp ngoài cùng tăng. Do đó khả năng nhường electron lớp ngoài cùng (để thể hiện tính khử) của kim loại nhóm IIA khó hơn so với kim loại nhóm IA.
Câu hỏi 2 trang 123 Hóa học 12: Dựa vào tính khử của kim loại và độ tan của các hydroxide, dự đoán:
a) Magnesium hay barium phản ứng với oxygen mạnh hơn.
b) Calcium hay barium phȧn ứng với nước mạnh hơn.
Lời giải:
a) Trong nhóm IIA, tính khử của kim loại tăng từ Be đến Ba. Do đó tính khử của Ba mạnh hơn Mg. Nên barium phản ứng với oxygen mạnh hơn magnesium.
b) Tính khử của Ca < Ba và độ tan trong nước của Ca(OH)2 cũng thấp hơn Ba(OH)2. Do đó barium phȧn ứng với nước mạnh hơn calcium.
Câu hỏi 3 trang 124 Hóa học 12: Vì sao magnesium phȧn ứng rất chậm với nước?
Một số bọt khí hydrogen xuất hiện khi cho magnesium vào nước ở điều kiện thường
Lời giải:
Magnesium phȧn ứng rất chậm với nước là vì độ tan trong nước của Mg(OH)2 tạo thành là rất thấp (0,0012 g/100 g nước ở 20°C). Phần Mg(OH)2 không tan này bám trên bề mặt Mg làm cản trở quá trình tiếp xúc của Mg với nước.
Lời giải:
Ngoài tham gia tạo hợp kim, các kim loại nhóm IIA còn có những ứng dụng như:
- Be: được sử dụng trong các vũ khí hạt nhân.
- Mg: được dùng để sản xuất pháo hoa.
- Ca: được dùng để điều chế các kim loại khác như uranium, thorium.
- Sr: được dùng để sản xuất pháo hoa.
- Ba: được dùng làm chất cản quang trong y tế.
…
Hình 18.3. Khung và cánh của máy bay trực thăng được chế tạo từ hợp kim của magnesium
Lời giải:
Magnesium là kim loại cơ bản trong hợp kim dùng để chế tạo khung và cánh của các thiết bị bay.
Ứng dụng này dựa trên tính chất nhẹ, cứng và bền của hợp kim magnesium.
Thí nghiệm 1 trang 125 Hóa học 12: So sánh độ tan của muối BaSO4 và CaSO4
Chuẩn bị:
- Hoá chất: Dung dịch BaCl2, CaCl2, cùng nồng độ 0,1 M; dung dịch CuSO4 5%.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho 2 mL dung dịch BaCl2 vào ống nghiệm (1), 2 mL dung dịch CaCl2 vào ống nghiệm (2). Cho từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm và lắc đều cho đến khi có kết tủa trong ống nghiệm thì dừng lại.
Yêu cầu: Quan sát hiện tượng, so sánh thời điểm xuất hiện kết tủa trong mỗi ống nghiệm, giải thích.
Lời giải:
Hiện tượng:
- Ống nghiệm (1) xuất hiện kết tủa trắng. Ống nghiệm (2) xuất hiện vẩn đục trắng.
- Thời điểm xuất hiện kết tủa ở ống nghiệm (1): ngay sau khi cho dung dịch CuSO4 vào. Thời điểm xuất hiện kết tủa ở ống nghiệm (2): sau khi cho dung dịch CuSO4 vào một lúc.
Phương trình hóa học:
BaCl2(aq) + CuSO4(aq) ⟶ CuCl2(aq) + BaSO4(s)
CaCl2(aq) + CuSO4(aq) ⟶ CuCl2(aq) + CaSO4(s)
Giải thích: Vì BaSO4 không tan trong nước còn CaSO4 ít tan trong nước.
Câu hỏi 4 trang 125 Hóa học 12: Phản ứng giữa các chất nào sau đây tạo ra chất không tan?
a) K2CO3 + Ca(OH)2 ⟶ ?
b) H2SO4 + NaOH ⟶ ?
c) HNO3 + Mg(OH)2 ⟶ ?
d) Na2SO4 + Ba(OH)2 ⟶ ?
Lời giải:
a) K2CO3 + Ca(OH)2 ⟶ 2KOH + CaCO3
b) H2SO4 + 2NaOH ⟶ Na2SO4 + 2H2O
c) 2HNO3 + Mg(OH)2 ⟶ Mg(NO3)2 + 2H2O
d) Na2SO4 + Ba(OH)2 ⟶ 2NaOH + BaSO4
Mà CaCO3 và BaSO4 là chất không tan trong nước.
Vậy phản ứng a và d tạo ra chất không tan.
Một mẫu khoáng vật calcite ở vùng Balkal, Nga
Lời giải:
Khoáng vật calcite có thành phần chủ yếu là CaCO3.
Khoáng vật dolomite có thành phần chủ yếu là MgCO3.CaCO3.
Mà CaCO3 và MgCO3 đều không tan trong nước.
Do đó, các khoáng vật calcite, dolomite,... hầu như không tan trong nước.
Lời giải:
Dựa vào bảng 18.3:
Ta thấy, MgCO3 không tan trong nước còn Mg(NO3)2 tan tốt trong nước.
Do đó có thể dùng nước để phân biệt MgCO3(s) và Mg(NO3)2(s).
Lời giải:
Dung dịch soda (Na2CO3) chứa ion Na+ và .
Phương trình hoá học của các phản ứng tạo chất không tan khi cho dung dịch soda vào mẫu nước giếng có chứa các ion Ca2+, Na+, Mg2+, Cl- và là:
Ca2+(aq) + (aq) ⟶ CaCO3(s)
Mg2+(aq) + (aq) ⟶ MgCO3(s)
Phần núi đá vôi trong nước biển dễ bị xói mòn
Lời giải:
Các rạn san hô và núi đá vôi có thành phần chính là CaCO3.
Mà CaCO3 phản ứng được với nước có carbon dioxide hòa tan theo phương trình hóa học:
CaCO3(s) + H2O(l) + CO2(aq) ⇌ Ca(HCO3)2(aq)
Khi tăng nồng độ của carbon dioxide trong nước biển thì cân bằng hóa học trên sẽ chuyển dịch theo chiều làm giảm nồng độ của carbon dioxide, tức là chiều của phản ứng thuận. Nên lượng CaCO3(s) bị giảm đi.
Do đó, khi có sự gia tăng nồng độ của carbon dioxide trong nước biển thì các rạn san hô và núi đá vôi có thể bị phá huỷ, xói mòn.
Lời giải:
Dựa vào Bảng 18.4: Giá trị biến thiên enthalpy chuẩn của phản ứng phân huỷ muối carbonate của một số nguyên tố nhóm IIA và xu hướng biến đổi nhiệt độ phân huỷ
Ta thấy, quá trình phân huỷ 1 mol muối carbonate của nguyên tố barium cần nhiều năng lượng nhất do biến thiên enthalpy chuẩn của phản ứng phân huỷ BaCO3 lớn nhất.
BaCO3(s) BaO(s) + CO2(g) ∆r = 271,5 kJ/mol.
Thí nghiệm 2 trang 127 Hóa học 12: Thí nghiệm kiểm tra sự có mặt của các ion Ca2+, Ba2+, ,
Thí nghiệm kiểm tra sự có mặt của ion Ca2+ trong dung dịch
Chuẩn bị:
- Hoá chất: Dung dịch CaCl2 0,1 M; Na2CO3 0,1 M; HCl 1,0 M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho vào ống nghiệm khoảng 2 mL dung dịch CaCl2, thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3 lắc đều. Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl, lắc đều.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hoá học của phản ứng xảy ra.
Thí nghiệm kiểm tra sự có mặt của ion Ba2+ trong dung dịch
Chuẩn bị:
- Hoá chất: Dung dịch BaCl2 0,1 M; H2SO4 1,0 M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho vào ống nghiệm khoảng 2 mL dung dịch BaCl2, thêm từ từ cho đến hết khoảng 6 – 8 giọt dung dịch H2SO4 lắc đều.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hoá học của phản ứng xảy ra.
Thí nghiệm kiểm tra sự có mặt của ion trong dung dịch
Chuẩn bị:
- Hoá chất: Dung dịch ZnSO4 0,1 M; BaCl2 0,1 M; HCI 1,0 M.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho vào ống nghiệm khoảng 2 mL dung dịch ZnSO4 thêm từ từ cho đến hết khoảng 10 giọt dung dịch BaCl2, lắc ống nghiệm. Tiếp tục thêm vào khoảng 2 – 3 giọt dung dịch HCl, lắc đều.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hoá học của phản ứng xảy ra.
Thí nghiệm kiểm tra sự có mặt của ion trong dung dịch
Chuẩn bị:
- Hoá chất: Dung dịch Na2CO3 1,0 M, HCl 1 M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, giấy chỉ thị pH.
Tiến hành: Cho vào ống nghiệm khoảng 1 mL dung dịch Na2CO3. Dùng giấy chỉ thị pH để kiểm tra môi trường dung dịch. Thêm tiếp 2 mL dung dịch HCl vào ống nghiệm, lắc đều, đưa que diêm đang cháy đến miệng ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
Thí nghiệm kiểm tra sự có mặt của ion Ca2+ trong dung dịch
Hiện tượng: Xuất hiện kết tủa trắng. Sau đó kết tủa tan dần khi thêm dung dịch HCl đồng thời có sủi bọt khí không màu.
Phương trình hóa học:
CaCl2(aq) + Na2CO3(aq) ⟶ CaCO3(s) + 2NaCl(aq)
CaCO3(s) + 2HCl(aq) ⟶ CaCl2(aq) + H2O(l) + CO2(g)
Thí nghiệm kiểm tra sự có mặt của ion Ba2+ trong dung dịch
Hiện tượng: Xuất hiện kết tủa trắng.
Phương trình hóa học:
BaCl2(aq) + H2SO4(aq) ⟶ BaSO4(s) + 2HCl(aq)
Thí nghiệm kiểm tra sự có mặt của ion trong dung dịch
Hiện tượng: Xuất hiện kết tủa trắng. Khi thêm dung dịch HCl không có hiện tượng xảy ra.
Phương trình hóa học:
BaCl2(aq) + ZnSO4(aq) ⟶ BaSO4(s) + ZnCl2(aq)
Thí nghiệm kiểm tra sự có mặt của ion trong dung dịch
Hiện tượng: Giấy chỉ thị pH chuyển màu xanh. Khi thêm dung dịch HCl thấy sủi bọt khí làm tắt que diêm đang cháy.
Phương trình hóa học:
Na2CO3(aq) + 2HCl(aq) ⟶ 2NaCl(aq) + H2O(l) + CO2(g)
Lời giải:
- Các triệu chứng của các bệnh về răng và xương có liên quan đến sự thiếu hụt calcium trong cơ thể: răng bị ố vàng, chân răng yếu, lung lay, dễ gãy rụng; xương dễ gãy, loãng xương, …
- Một số biện pháp phòng tránh, hạn chế các bệnh về răng và xương có liên quan đến sự thiếu hụt calcium trong cơ thể:
+ Bổ sung thường xuyên trong khẩu phần ăn hàng ngày các thực phẩm giàu calcium như: sữa, ngũ cốc, các loại hạt, rau cải, hải sản, …
+ Tập thể dục thường xuyên.
+ Duy trì lối sống tích cực, hạn chế sự căng thẳng.
Bài tập
Lời giải:
- Giống nhau:
+ Bán kính nguyên tử lớn hơn so với các nguyên tố khác trong cùng chu kì, số electron lớp ngoài cùng ít.
+ Là kim loại nhẹ, khối lượng riêng nhỏ, nhiệt độ nóng chảy tương đối thấp.
+ Có tính khử mạnh thể hiện qua các phản ứng tác dụng với các chất như phi kim (O2, Cl2, …), H2O, …
- Khác nhau:
|
Kim loại kiềm |
Kim loại nhóm IIA |
|
|
Cấu tạo nguyên tử |
- Có 1e lớp ngoài cùng - Có cùng kiểu mạng tinh thể lập phương tâm khối. |
- Có 2e lớp ngoài cùng - Có 3 kiểu mạng tinh thể: lập phương tâm khối, lập phương tâm diện và lục phương. |
|
Tính chất vật lý |
- Khối lượng riêng, nhiệt độ nóng chảy tăng dần theo chiều tăng của điện tích hạt nhân. |
- Theo chiều tăng của điện tích hạt nhân, khối lượng riêng, nhiệt độ nóng chảy biến đổi không theo xu hướng nhất định. |
|
Tính chất hóa học |
- Tính khử rất mạnh M ⟶ M+ + 1e |
- Tính khử mạnh M ⟶ M2+ + 2e |
a) Sắp xếp Na, Mg, Cu theo dãy tăng dần tính khử của kim loại.
b) Giải thích vì sao Na và Mg tác dụng được với nước.
Lời giải:
a) Ta có: < <
Do đó tính khử của kim loại Na > Mg > Cu.
Sắp xếp theo dãy tăng dần tính khử của kim loại là: Cu, Mg, Na.
b) Ta có thế điện cực chuẩn của Na và Mg đều nhỏ hơn = – 0,413 V ở pH = 7. Do đó, Na và Mg đều tác dụng được với nước.
Lời giải:
Khi cho soda (Na2CO3) vào dung dịch Na2CO3 phân li tạo thành 2 ion: Na+ và
Cation Ca2+ và Mg2+ bị tách ra khỏi dung dịch theo phương trình hóa học:
Ca2+(aq) + (aq) ⟶ CaCO3(s)
Mg2+(aq) + (aq) ⟶ MgCO3(s)
Lời giải:
- Trích nhỏ mẫu thử rồi đánh số thứ tự.
- Cho quỳ tím vào từng mẫu thử.
+ Mẫu thử làm quỳ tím chuyển màu xanh là: Na2CO3
Na2CO3 ⟶ 2Na+ +
+ H2O ⇌ + OH−
+ Các mẫu thử không làm quỳ tím chuyển màu là: CaCl2, BaCl2, KCl, NaCl
- Dùng que platinum sạch nhúng vào từng mẫu thử còn lại rồi đưa lên ngọn lửa đèn khí.
+ Mẫu thử cho ngọn lửa màu đỏ cam là: CaCl2
+ Mẫu thử cho ngọn lửa màu lục là: BaCl2
+ Mẫu thử cho ngọn lửa màu tím là: KCl
+ Mẫu thử cho ngọn lửa màu vàng là: NaCl
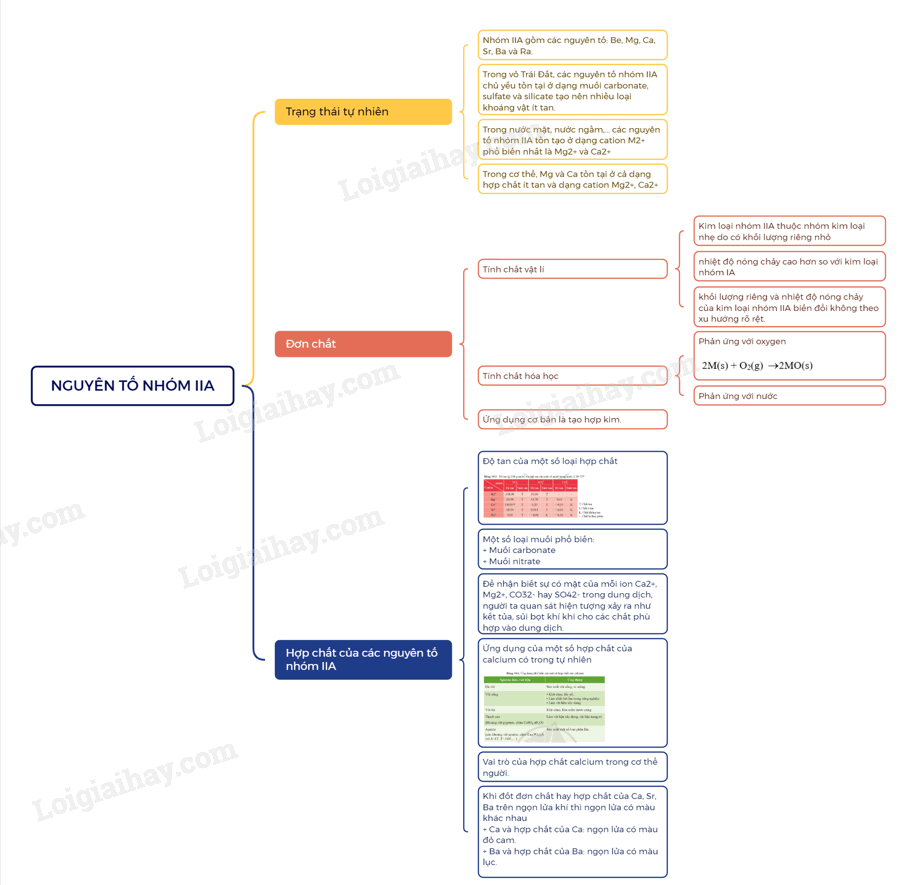
Lý thuyết Nguyên tố nhóm IIA
I. Trạng thái tự nhiên
- Nhóm IIA gồm các nguyên tố: Be, Mg, Ca, Sr, Ba và Ra.
- Trong vỏ Trái Đất, các nguyên tố nhóm IIA chủ yếu tồn tại ở dạng muối carbonate, sulfate và silicate tạo nên nhiều loại khoáng vật ít tan.
- Trong nước mặt, nước ngầm,… các nguyên tố nhóm IIA tồn tạo ở dạng cation M2+ phổ biến nhất là Mg2+ và Ca2+
- Trong cơ thể, Mg và Ca tồn tại ở cả dạng hợp chất ít tan và dạng cation Mg2+, Ca2+
II. Đơn chất
1. Tính chất vật lí
- Bán kính nguyên tử và một số tính chất vật lí của kim loại nhóm IIA được thể hiện qua bảng sau:
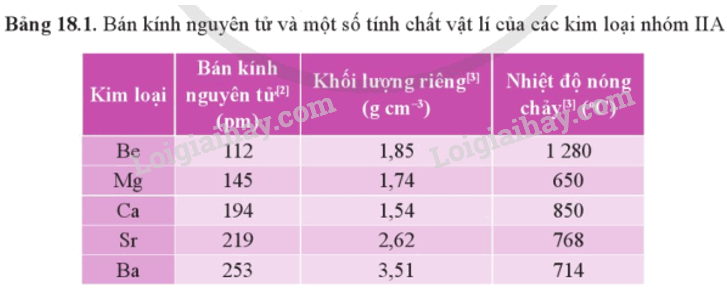
- Kim loại nhóm IIA thuộc nhóm kim loại nhẹ do có khối lượng riêng nhỏ. Chúng có nhiệt độ nóng chảy cao hơn so với kim loại nhóm IA, nhưng tương đối thấp so với các kim loại khác.
- Khác với kim loại kiềm, khối lượng riêng và nhiệt độ nóng chảy của kim loại nhóm IIA biến đổi không theo xu hướng rõ rệt.
2. Tính chất hóa học
a) Phản ứng với oxygen
Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc cháy, tạo ra oxide theo phương trình hóa học tổng quát sau:
2M(s) + O2(g) 2MO(s)
Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng.
b) Phản ứng với nước
Be không tan trong nước, Mg phản ứng với nước rất chậm ở nhiệt độ thường, phản ứng mạnh hơn khi đun nóng. Ca, Sr, Ba phản ứng mạnh với nước ở nhiệt độ thường.
3. Ứng dụng
Ứng dụng cơ bản của một số kim loại nhóm IIA là tham gia tạo hợp kim.
III. Hợp chất của các nguyên tố nhóm IIA
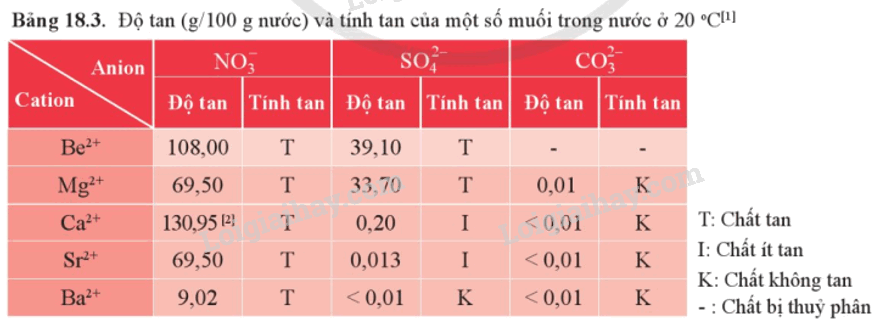
1. Độ tan của một số loại hợp chất
2. Một số loại muối phổ biến
a) Muối carbonate
- Muối carbonate của các nguyên tố Mg, Ca, Sr, Ba phản ứng với dung dịch acid, với nước có carbon dioxide hòa tan.
Ví dụ: CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g)
CaCO3(s) + H2O(l) + CO2(aq) Ca(HCO3)2(aq)
- Các muối carbonate bị nhiệt phân, tạo thành oxide kim loại và khí carbon dioxide:
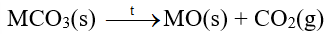
b) Muối nitrate
- Các muối nitrate của nguyên tố nhóm IIA bị nhiệt phân tạo oxide kim loại, khí nitrogen dioxide và oxygen.
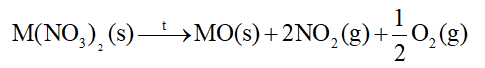
- Độ bền nhiệt của các muối nitrate có xu hướng tăng từ Mg(NO3)2 đến Ba(NO3)2.
3. Kiểm tra sự có mặt của ion trong dung dịch
Để nhận biết sự có mặt của mỗi ion Ca2+, Mg2+, CO32- hay SO42- trong dung dịch, người ta quan sát hiện tượng xảy ra như kết tủa, sủi bọt khí khi cho các chất phù hợp vào dung dịch.
4. Ứng dụng và vai trò của một số hợp chất của calcium
a) Ứng dụng của một số hợp chất của calcium có trong tự nhiên
thạch cao, apatite, đá vôi, vôi sống, vôi tôi có thành phần chính là các hợp chất của calcium. Chúng là nguyên liệu, vật liệu phổ biến và có nhiều ứng dụng trong đời sống, sản xuất.

b) Vai trò của hợp chất calcium trong cơ thể người
Trong cơ thể người:
+ Một số hợp chất không tan của calcium cấu tạo nên xương và răng, giúp phát triển, ổn định xương và răng.
+ Một số hợp chất tan của calcium giúp ổn định chức năng truyền dẫn tín hiệu thần kinh đến tế bào, chức năng co giãn của cơ bắp.
IV. Nhận biết kim loại và ion kim loại nhóm IIA
Khi đốt đơn chất hay hợp chất của Ca, Sr, Ba trên ngọn lửa khí thì ngọn lửa có màu khác nhau
+ Ca và hợp chất của Ca: ngọn lửa có màu đỏ cam.
+ Ba và hợp chất của Ba: ngọn lửa có màu lục.
Sơ đồ tư duy nhóm IIA
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất
Bài 22. Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch