Với giải sách bài tập Hóa học 12 Bài 14: Tính chất hoá học của kim loại sách Cánh diều hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 12. Mời các bạn đón xem:
Sách bài tập Hóa học 12 Bài 14: Tính chất hoá học của kim loại
Bài 14.1 trang 46 Sách bài tập Hóa học 12: Những phát biểu nào sau đây là đúng?
(a) Tính chất hoá học đặc trưng của kim loại là tính khử.
(b) Kim loại càng hoạt động hoá học thì tính khử càng mạnh.
(c) Những kim loại kém hoạt động hoá học (trơ) như vàng, platinum không thể hiện tính khử.
(d) Kim loại bạc có tính khử yếu trong khi cation Ag+ có tính oxi hoá mạnh.
(e) Kim loại mạnh có thể khử các kim loại yếu hơn trong hợp kim.
Lời giải:
Các phát biểu (a), (b), (d) đúng.
Phát biểu (c) sai vì tính chất hoá học cơ bản của kim loại là tính khử.
Phát biểu (e) sai, vì kim loại không khử kim loại mà chỉ có thể khử cation của kim loại yếu hơn trong hợp chất.
Bài 14.2 trang 46 Sách bài tập Hóa học 12: Những phát biểu nào sau đây là đúng?
(a) Thông thường, kim loại M hoạt động càng mạnh thì giá trị thế điện cực chuẩn của cặp oxi hoá - khử Mn+/M càng âm.
(b) Kim loại M càng kém hoạt động thì giá trị thế điện cực chuẩn của cặp oxi hoá - khử Mn+/M càng dương.
(c) Trong cặp oxi hoá - khử thì H2O là dạng khử, H2 là dạng oxi hoá.
(d) Magnesium là kim loại có độ hoạt động hoá học mạnh hơn nhôm (aluminium), giá trị thế điện cực chuẩn của cặp Mg2+/ Mg âm hơn giá trị thế điện cực chuẩn của cặp Al3+/ Al.
Lời giải:
Các phát biểu (a), (b), (d), đúng.
Phát biểu (c) sai, vì H2O là dạng oxi hoá với số oxi hoá của H là +1, H2 là dạng khử.
Bài 14.3 trang 46 Sách bài tập Hóa học 12: Dựa vào giá trị thế điện cực chuẩn của các cặp oxi hoá - khử liên quan, hãy cho biết trường hợp nào sau đây không có phản ứng hoá học xảy ra ở điều kiện chuẩn. Viết phương trình hoá học của các phản ứng xảy ra.
a) Cho kẽm (zinc) vào dung dịch tin(II) sulfate.
b) Cho sắt (iron) vào dung dịch magnesium nitrate.
c) Cho chì (lead) vào dung dịch hydrochloric acid.
d) Cho chì vào dung dịch zinc chloride.
e) Cho đồng (copper) vào nước.
Lời giải:
Dựa vào giá trị thế điện cực chuẩn của các cặp oxi hoá – khử liên quan xác định được:
b), d), e) không xảy ra phản ứng ở điều kiện chuẩn
a) Zn + SnSO4 ZnSO4 + Sn
c) Pb + 2HCl PbCl2 + H2
Bài 14.4 trang 47 Sách bài tập Hóa học 12: Ở môi trường trung tính, quá trình có giá trị Những phát biểu nào sau đây không đúng?
(a) Những kim loại M có thế điện cực chuẩn đều khử được nước ở điều kiện thường.
(b) Sodium khử được nước theo phương trình hoá học:
nên .
(c) Nước đóng vai trò là chất khử khi phản ứng với kim loại M (như Na, K) có thế điện cực chuẩn .
(d) Khí hydrogen là sản phẩm khử của nước khi nước phản ứng với kim loại mạnh như Na, K.
Lời giải:
Các phát biểu (a), (c) không đúng.
(a) sai, vì nhiều kim loại có thế khử nhỏ hơn -0,413 V vẫn không phản ứng với nước ở điều kiện thường như Fe, Zn.
(c) sai, vì trong phản ứng giữa nước và các kim loại như Na, K, nước đóng vai trò là chất oxi hoá, kim loại đóng vai trò là chất khử.
Bài 14.5 trang 47 Sách bài tập Hóa học 12: Thả một đinh sắt nặng m1 gam đã được đánh sạch bề mặt vào cốc chứa dung dịch copper(II) sulfate màu xanh. Sau một thời gian thấy toàn bộ lượng đồng sinh ra đã bám vào "đinh sắt" (thực chất là phần đinh sắt chưa phản ứng). Lấy "đinh sắt" ra khỏi cốc dung dịch, sấy khô, đem cân được m2 gam.
Mỗi phát biểu sau đây là đúng hay sai?
(a) Phản ứng diễn ra là:
(b) Màu xanh của dung dịch copper(II) sulfate nhạt dần.
(c) So sánh, thu được kết quả m2 < m1.
(d) Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
Lời giải:
(a) Sai, vì phản ứng tạo thành họp chất iron(II):
Fe(s) + Cu2+(aq) → Fe2+(aq) + Cu(s).
(b) Đúng, màu xanh của dung dịch nhạt dần do nồng độ Cu2+ giảm dần trong phản ứng.
(c) Sai, tỉ lệ mol của Fe và Cu theo phản ứng là 1 : 1. Nếu 1 mol Fe tham gia phản ứng và tan (56 g) sẽ có 1 mol Cu sinh ra và bám vào “đinh sắt”. Vì lượng kim loại tan ra nhỏ hơn lượng bám vào (56 g < 64 g) nên làm cho khối lượng của “đinh sắt” lớn hơn khối lượng của đinh sắt ban đầu.
(d) Sai, vì xảy ra phản ứng Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s). Khi đó, nồng độ Cu2+ giảm do bị khử bởi Zn và màu xanh của dung dịch nhạt dần.
Bài 14.6 trang 47 Sách bài tập Hóa học 12: Cho một ít bột nhôm vào muỗng đốt hoá chất rồi đốt trên ngọn lửa đèn cồn. Khi một phần bột nhôm trong muỗng cháy đỏ thì đưa nhanh muỗng vào bình chứa oxygen dư. Bột nhôm cháy nhanh và phát ra ánh sáng màu trắng rất mạnh, tạo thành hợp chất A.
Mỗi phát biểu dưới đây đúng hay sai?
(a) Nhôm bị khử tạo thành hợp chất A.
(b) Số oxi hoá của nhôm trong hợp chất A là +3 .
(c) Biến thiên enthalpy chuẩn của phản ứng giữa nhôm và oxygen có giá trị âm .
(d) Phản ứng trên liên quan đến 2 cặp oxi hoá - khử là Al3+/ Al và O2/2O2-.
Lời giải:
(a) Sai vì nhôm bị oxi hoá tạo thành hợp chất A;
(b) Đúng;
(c) Đúng;
(d) Đúng.
Bài 14.7 trang 48 Sách bài tập Hóa học 12: Cho 3 thí nghiệm sau:
- Thí nghiệm 1: Cho một mẩu sodium vào nước đã thêm vài giọt dung dịch phenolphthalein.
- Thí nghiệm 2: Cho một mẩu kẽm vào dung dịch hydrochloric acid loãng.
- Thí nghiệm 3: Cho một mẩu đồng vào dung dịch sulfuric acid đặc.
Mỗi phát biểu dưới đây là đúng hay sai?
(a) Các kim loại bị oxi hoá trong cả ba thí nghiệm trên.
(b) Cả ba dung dịch đều đổi màu trong quá trình phản ứng.
(c) Thí nghiệm 3 có sinh ra khí Z. Tỉ khối hơi của khí Z so với khí X thoát ra ở thí nghiệm 1 là 32 .
(d) Tổng hệ số tối giản của các chất trong phương trình hoá học ở thí nghiệm 3 là 6 .
Lời giải:
Thí nghiệm 1: 2Na + 2H2O → 2NaOH + H2 (1)
Thí nghiệm 2: Zn + 2HCl → ZnCl2 + H2 (2)
Thí nghiệm 3: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O (3)
(a) Đúng. Cả ba kim loại đều bị oxi hoá.
(b) Sai. Trong thí nghiệm 1, dung dịch chuyển sang màu hồng do tạo dung dịch base (NaOH); Thí nghiệm 2, dung dịch không đổi màu do dung dịch muối zinc chloride không màu; Thí nghiệm 3, dung dịch chuyển sang màu xanh do tạo thảnh muối copper(II) sulfate.
(c) Đúng. Khí Z là SO2, khí X là H2. Tỉ khối hơi
(d) Sai. Tổng hệ số cân bằng trong phương trình (3) bằng 7.
Bài 14.8 trang 48 Sách bài tập Hóa học 12: Dựa vào giá trị thế điện cực chuẩn của các cặp oxi hoá khử với M là Cu, Hg, K và Zn, hãy:
a) Sắp xếp các kim loại theo chiều tính khử tăng dần.
b) Sắp xếp các cation Cu2+, Hg2+, K+, Zn2+ theo chiều tính oxi hoá tăng dần.
c) Cho biết kim loại nào có khả năng phản ứng với dung dịch hydrochloric acid ở điều kiện thường.
Lời giải:
a) Tính khử tăng dần theo dãy: Hg < Cu < Zn < K.
b) Kim loại có tính khử càng mạnh thì cation tương ứng có tính oxi hoá càng yếu. Tính oxi hoá tăng dần theo dãy: K+ < Zn2+ < Cu2+ < Hg2+.
c) Kim loại M có giá trị thế điện cực chuẩn âm có thể tác dụng với hydrochloric acid ở điều kiện thường: Zn, K.
Tuy nhiên KHÔNG cho trực tiếp potassium vào dung dịch acid vì phản ứng xảy ra rất mãnh liệt và gây nổ.
Bài 14.9 trang 48 Sách bài tập Hóa học 12: Nhóm những kim loại nào sau đây không phản ứng với dung dịch sulfuric acid đặc, nguội?
A. Fe, Al, Ag.
B. Fe, Au, Cr.
C. Fe, Al, Zn.
D. Al, Cr, Zn.
Lời giải:
Đáp án đúng là: B
Các kim loại Fe, Au, Cr không phản ứng với dung dịch sulfuric acid đặc, nguội.
Bài 14.10 trang 48 Sách bài tập Hóa học 12: Trường hợp nào sau đây có xảy ra phản ứng hoá học? Giải thích và viết phương trình hoá học (nếu có).
a) Kim loại đồng nhúng trong dung dịch zinc sulfate.
b) Kim loại kẽm nhúng trong dung dịch silver nitrate.
c) Thả một mẩu sodium vào dung dịch copper(II) sulfate.
d) Rắc bột lưu huỳnh lên phần thuỷ ngân chảy ra từ nhiệt kế bị vỡ.
e) Thả một mẩu magnesium nóng đỏ vào nước.
Lời giải:
a) Không xảy ra phản ứng.
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag.
c) 2Na + 2H2O → 2NaOH + H2.
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4.
d) Hg + S → HgS.
e) Mg + 2H2O → Mg(OH)2 + H2.
Bài 14.11 trang 48 Sách bài tập Hóa học 12: Giải thích vì sao trong tự nhiên hầu như không tìm thấy các oxide của vàng.
Lời giải:
Do vàng có độ hoạt động hoá học yếu, có thế điện cực chuẩn lớn, “quá trình hình thành oxide của vàng (Au2O3) không thuận lợi về mặt năng lượng” nên trong tự nhiên hầu như không tìm thấy các oxide của vàng.
Lý thuyết Tính chất hoá học của kim loại
I. Tác dụng với phi kim
Nhiều kim loại tác dụng được với các phi kim như oxygen, lưu huỳnh, halogen,…
Ví dụ:
II. Tác dụng với nước
Trong môi trường trung tính, có:
2H2O + 2e H2 + OH- với E2H2O/2OH-+H2 = -0,413V
Cặp oxi hóa – khử Mn+/M có giá trị thế điện cực chuẩn nhỏ hơn – 0,413V thì kim loại M có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen
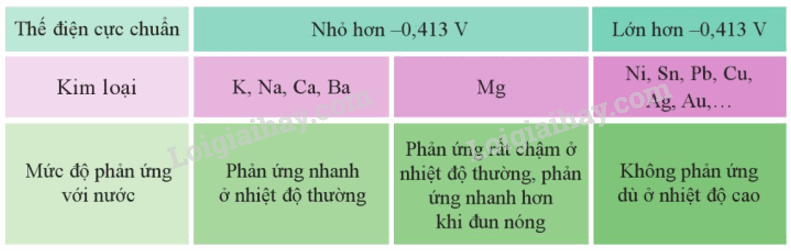
III. Tác dụng với dung dịch muối
Kim loại không tan trong nước và có giá trị thế điện cực chuẩn nhỏ hơn thường tác dụng được với dung dịch muối của kim loại có giá trị thế điện cực lớn hơn ở điều kiện chuẩn.
Ví dụ: Zn(s) + CuSO4(aq) ZnSO4(aq) + Cu(s)
IV. Tác dụng với dung dịch acid
1. Tác dụng với dung dịch hydrochloric acid, dung dịch sulfuric acid loãng
Do nên kim loại M có giá trị thế điện cực chuẩn có theẻ khử được ion H+ trong dung dịch hydrchloric acid hoặc dung dihcj sulfuric acid loãng, tạo thành khí H2
Ví dụ: Zn(s) + 2H+(aq) Zn2+ (aq) + H2(g)
Do giá trị thế điện cực chuẩn dương nên các kim loại như Cu, Ag,… không tác dụng với dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng.
2. Tác dụng với dung dịch sulfuric acid đặc
Hầu hết các kim loại (trừ Au và Pt) phản ứng được với dung dịch sulfuric acid đặc. Phản ứng này thường tạo thành muối sulfate, nước và sulfur dioxide. Phản ứng diễn ra mạnh hơn khi hỗn hợp phản ứng được đun nóng
Ví dụ: 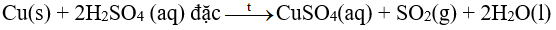
Xem thêm các bài giải SBT Hóa học lớp 12 Cánh diều hay, chi tiết khác:
Bài 13: Cấu tạo và tính chất vật lí của kim loại
Bài 14: Tính chất hoá học của kim loại
Bài 15: Tách kim loại và tái chế kim loại