Lời giải bài tập Hóa học lớp 12 Bài 13: Cấu tạo và tính chất vật lí của kim loại sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 13: Cấu tạo và tính chất vật lí của kim loại
a) Ứng dụng trên dựa vào tính chất vật lí nào của kim loại chì?
b) Các kim loại có những tính chất vật lí chung nào? Vì sao?
Lời giải:
a) Ứng dụng trên dựa vào tính dẫn điện và nhiệt độ nóng chảy của kim loại.
Khi dòng điện đi qua cầu chì vượt mức cho phép, nhiệt độ qua dây chì tăng cao, khi đó dây chì bị nóng chảy và đứt, xảy ra hiện tượng đoản mạch, mạch điện bị ngắt. Nếu không ngắt mạch kịp thời thì có thể dẫn đến nguy cơ hư hỏng thiết bị hay thậm chí là cháy, nổ.
b) Các kim loại có tính chất vật lí chung là: dẫn điện, dẫn nhiệt, tính dẻo, tính ánh kim.
Các tính chất này chủ yếu do các electron hóa trị tự do trong tinh thể kim loại gây ra.
Lời giải:
Trong mạng tinh thể kim loại, các electron hoá trị tự do chuyển động theo nhiều hướng.
Câu hỏi 1 trang 90 Hóa học 12: Nhờ tính chất vật lí nào mà ta có thể uốn cong được kim loại?
Dây kim loại được uốn cong
Lời giải:
Nhờ vào tính dẻo của kim loại mà ta có thể uốn cong được kim loại.
Câu hỏi 2 trang 91 Hóa học 12: Dưới đây là mô hình mô tả tính chất nào của kim loại? Giải thích.
Lời giải:
Mô hình mô tả tính dẫn điện của kim loại.
Dựa vào hình vẽ ta thấy có hiệu điện thế đặt vào hai đầu dây kim loại, khi đó dưới tác dụng của điện trường, các electron hóa trị tự do đang chuyển động hỗn loạn trong tinh thể kim loại chuyển động thành dòng, có hướng từ cực âm đến cực dương tạo thành dòng điện.
Lời giải:
- Nhờ vào tính dẻo mà vàng có thể dát mỏng và tạo hình để làm đồ trang sức.
- Nhờ vào tính ánh kim mà vàng có bề mặt lấp lánh để làm đồ trang sức.
Lời giải:
Các kim loại đều có tính chất vật lí chung là dẫn điện, dẫn nhiệt, tính dẻo và có ánh kim là do trong cấu tạo mạng tinh thể kim loại có các electron hóa trị tự do chuyển động.
Lời giải:
Kim loại nặng sẽ được dùng để chế tạo mỏ neo vì kim loại nặng có khối lượng riêng lớn, chìm xuống đáy sông và giữ cho tàu thuyền không bị trôi.
Lời giải:
|
Vật dụng, thiết bị |
Kim loại |
Tính chất |
|
Vỏ lon bia, nước ngọt |
Nhôm |
Cứng vừa phải và dẻo |
|
Khung cửa |
Nhôm |
Cứng vừa phải và dẻo |
|
Ấm đun nước, xoong, nồi |
Nhôm |
Dẫn nhiệt tốt |
|
Dây dẫn điện |
Đồng |
Dẫn điện tốt |
|
Dao |
Sắt |
Tính dẻo, cứng, bền |
Bài tập
Bài 1 trang 94 Hóa học 12: Chỉ ra sự khác nhau giữa liên kết kim loại và liên kết ion.
Lời giải:
Liên kết kim loại là liên kết được hình thành từ lực hút tĩnh điện giữa các cation kim loại và các electron tự do trong tinh thể kim loại.
Liên kết ion được tạo thành nhờ lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
Lời giải:
- Buộc một mẩu chì vào dây của cần câu vì chì là kim loại nặng (có khối lượng riêng lớn) làm dây cần câu chìm sâu xuống nước.
- Không dùng mẩu nhôm vì nhôm là kim loại nhẹ (có khối lượng riêng nhỏ), dây cần câu không chìm được sâu dưới nước.
Lời giải:
Không nên dùng đoạn dây đồng hoặc thép (thành phần chính là sắt) để làm dây chảy thay thế.
Vì chì có nhiệt độ nóng chảy thấp hơn nhiều so với đồng và sắt. Khi xảy ra sự cố làm tăng nhiệt độ dây cầu chì sẽ nóng chảy và ngắt mạch điện.
Nhiệt độ nóng chảy của đồng và sắt cao hơn nhiều so với chì nên sẽ không nóng chảy và ngắt mạch điện được, dẫn đến nhiệt độ tăng quá cao có thẻ gây cháy, nổ.
Lý thuyết Cấu tạo và tính chất vật lí của kim loại
I. Đặc điểm cấu tạo và liên kết kim loại
1. Đặc điểm cấu tạo
Nguyên tử kim loại có các đặc điểm sau:
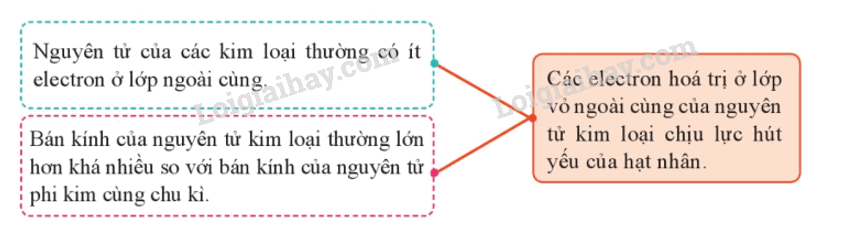
2. Cấu tạo tinh thể kim loại
- Ở điều kiện thường, trừ thủy ngân ở thể lỏng, các kim loại khác đều tồn tại ở thể rắn và có cấu tạo tinh thể.
- Trong tinh thể kim loại, do chịu lực hút yếu của hạt nhân nguyên tử nên electron hóa trị dễ tách ra khỏi nguyên tử, tạo thành electron hóa trị tự do và cation kim loại. Vì vậy, tinh thể kim loại chứa các cation kim loại sắp xếp theo trật tự nhất định cùng với electron hóa trị chuyển độ tự do trong tinh thể.
3. Liên kết kim loại
Liên kết kim loại là liên kết được hình thành từ lực hút tĩnh điện giữa các cation kim loại và các electron hóa trị tự do trong tinh thể kim loại.
II. Tính chất vật lí và một số ứng dụng của kim loại
1. Tính chất vật lí chung và ứng dụng
a) Tính dẻo
kim loại có tính dẻo nên dễ rèn, dễ dát mỏng và dễ kéo sợi
Tính chất này là do các cation kim loại trong tinh thể kim loại có thể trượt lên nhau mà không tách rời nhờ lực hút tĩnh điện giữa chúng với các electron hóa trị tự do.
b) Tính dẫn điện
Kim loại có tính dẫn điện. Tính dẫn điện tốt nhất là bạc, sau đó đến đồng, vàng, nhôm, sắt,…
c) Tính dẫn nhiệt
Khi đốt nóng một đầu dây kim loại, các electron hóa trị tự do ở vùng nhiệt độ cao có động năng lớn hơn di chuyển đến vùng có nhiệt độ thấp hơn trong tinh thể kim loại và truyền năng lượng cho các cation kim loại ở đây.
d) Ánh kim
Các electron hóa trị tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng mà mắt con người nhìn thấy được, do đó kim loại có bề ngoài sáng lấp lánh, còn gọi là ánh kim
2. Tính chất vật lí riêng và một số ứng dụng
Kim loại còn có một số tính chất vật lí riêng như khối lượng riêng, nhiệt độ nóng chảy và tính cứng.
Kim loại nhẹ nhất là Li, kim loại có khối lượng riêng nặng nhất là Os. Nhiệt độ nóng chảy cao nhất là W, kim loai cứng nhất là Cr.
Sơ đồ tư duy Cấu tạo và tính chất vật lí của kim loại
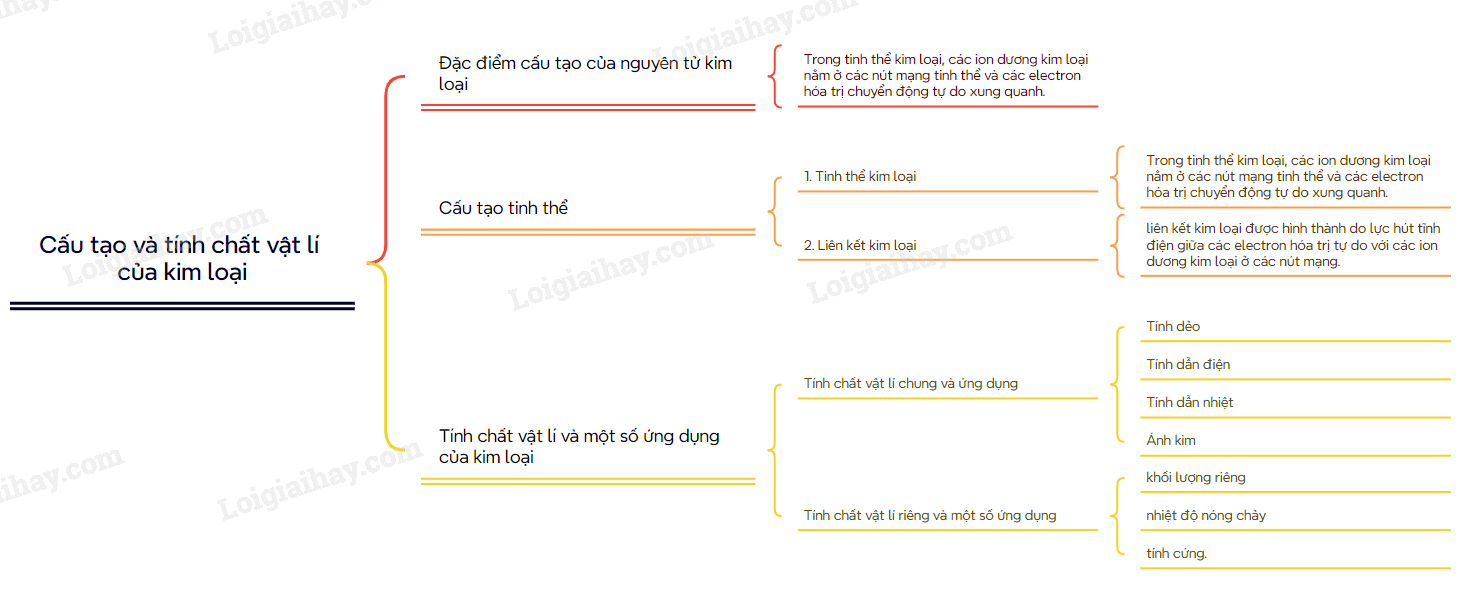
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 13. Cấu tạo và tính chất vật lí của kim loại
Bài 14. Tính chất hoá học của kim loại
Bài 15. Tách kim loại và tái chế kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại