Lời giải bài tập Hóa học lớp 12 Bài 17: Nguyên tố nhóm IA sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 17: Nguyên tố nhóm IA
Hình 17.1. Một số ứng dụng của hợp chất của nguyên tố nhóm IA
a) Nêu một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IA mà em biết.
b) Kim loại nhóm IA có những tính chất vật lí và tính chất hoá học đặc trưng nào?
Lời giải:
a) Một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IA:
Li: Nguyên liệu sản xuất pin.
NaCl: Muối ăn, chế biến và bảo quản thực phẩm, làm nguyên liệu chính của quy trình công nghiệp chlorine – kiềm.
NaOH: Dùng trong chế biến dầu mỏ, sản xuất nhôm, giấy, xà phòng và nhiều hóa chất khác.
NaHCO3:
- Điều chỉnh vị chua của nước giải khát.
- Làm tăng độ xốp của bánh và mềm thực phẩm.
Na2CO3:
- Dùng làm chất tẩy rửa dầu, mỡ.
- Làm mềm nước cứng, nguyên liệu sản xuất thủy tinh, giấy.
KNO3: Nguyên liệu sản xuất thuốc súng.
K2SO4: Sản xuất phân bón.
Các hợp chất của Rb được sử dụng trong pháo hoa.
Cs: được sử dụng trong các tế bào quang điện.
b)
- Tính chất vật lí đặc trưng của kim loại nhóm IA: Khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại nhóm khác. Cấu trúc tinh thể khá rỗng (kiểu mạng tinh thể lập phương tâm khối) và có lực liên kết kim loại yếu. Do đó có thể cắt kim loại kiềm bằng dao, kéo.
- Tính chất hóa học đặc trưng của kim loại nhóm IA: Tính khử mạnh do giá trị rất nhỏ. M ⟶ M+ + e
Phản ứng mạnh với nước, oxygen, chlorine và nhiều chất oxi hóa khác, …
Lời giải:
Hai hợp chất có nhiều ứng dụng trong thực tế của sodium: NaCl (muối ăn), NaHCO3 (baking soda).
Hai hợp chất có nhiều ứng dụng trong thực tế của potassium: KNO3 (thuốc súng), K2SO4 (phân bón).
Lời giải:
Hiện tượng: Mẩu lithium nổi trên bề mặt dầu hỏa khan.
Vì khối lượng riêng của lithium là 0,53 g/cm3 nhỏ hơn khối lượng riêng của dầu hỏa khan là 0,80 g/cm3.
Câu hỏi 3 trang 115 Hóa học 12: Dự đoán potassium hay lithium phản ứng với nước mạnh hơn.
Lời giải:
Trong nhóm IA, tính khử của kim loại kiềm tăng từ lithium đến caesium nên tính khử của Li < K.
Do đó, ta có thể dự đoán potassium phản ứng với nước mạnh hơn lithium.
Thí nghiệm 1 trang 115 Hóa học 12: Tác dụng với nước
Dùng panh lấy mẩu kim loại (Li, Na hoặc K) cho vào chậu thuỷ tinh chứa khoảng thể tích nước. Thêm vài giọt dung dịch phenolphthalein vào chậu sau khi kim loại tan hết.
Yêu cầu: Nêu các hiện tượng và so sánh mức độ phản ứng.
Lời giải:
Hiện tượng:
- Li chạy từ từ trên mặt nước, có khí bay lên mãnh liệt. Dung dịch chuyển màu hồng khi thêm vài giọt dung dịch phenolphthalein.
- Na chạy nhanh trên mặt nước thành hình vòng tròn, có khí bay lên mãnh liệt. Dung dịch chuyển màu hồng khi thêm vài giọt dung dịch phenolphthalein.
- K chạy nhanh trên mặt nước, có phát nổ và bốc cháy nhẹ, có khí bay lên mãnh liệt. Dung dịch chuyển màu hồng khi thêm vài giọt dung dịch phenolphthalein.
Như vậy, mức độ phản ứng với nước của Li < Na < K.
Thí nghiệm 2 trang 115 Hóa học 12: Tác dụng với oxygen
Dùng panh lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí oxygen. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác.
Yêu cầu: Quan sát hiện tượng thí nghiệm.
Lời giải:
Hiện tượng: Các mẩu kim loại nóng chảy khi hơ trên lửa đèn cồn và bốc cháy mãnh liệt trong bình khí oxygen, xuất hiện khói trắng.
- Li khi cháy cho ngọn lửa đỏ tía.
- Na khi cháy cho ngọn lửa màu vàng.
- K khi cháy cho ngọn lửa màu tím.
Thí nghiệm 3 trang 116 Hóa học 12: Tác dụng với chlorine
Dùng panh lấy mẫu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí chlorine. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác.
Yêu cầu: Quan sát hiện tượng thí nghiệm.
Lời giải:
Hiện tượng: Các mẩu kim loại nóng chảy khi hơ trên lửa đèn cồn và bốc cháy mãnh liệt trong bình khí clorine, xuất hiện khói trắng, màu vàng của bình khí chlorine nhạt dần.
- Li khi cháy cho ngọn lửa đỏ tía.
- Na khi cháy cho ngọn lửa màu vàng.
- K khi cháy cho ngọn lửa màu tím.
Lời giải:
2Na(s) + 2H2O(l) ⟶ 2NaOH(aq) + H2(g)
2Na(s) + Cl2(g) ⟶ 2NaCl(s)
4Na(s) + O2(g) ⟶ 2Na2O(s)
Lời giải:
Vì chất béo trong dầu mỡ bị thủy phân trong môi trường kiềm. Mà dung dịch soda (Na2CO3) có tính kiềm cao hơn baking soda (NaHCO3) do đó khả năng tẩy rửa dầu mỡ của soda tốt hơn và tiết kiệm hơn. Do đó nên dùng soda, không nên dùng baking soda để tẩy rửa lớp bám này.
Lời giải:
Một số lợi ích của việc tái tạo và tái sử dụng ammonia trong phương pháp Solvay:
- Làm giảm lượng ammonia (NH3) cần dùng.
- Giảm chi phí sản xuất, giúp hạ giá thành của sản phẩm baking soda và soda.
Thí nghiệm 4 trang 119 Hóa học 12: Phân biệt các cation Li+, Na+, K+
Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào dung dịch lithium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí.
Thực hiện thao tác tương tự đối với mỗi dung dịch sodium chloride 25% và dung dịch potassium chloride 25%.
Yêu cầu: Nêu hiện tượng quan sát được.
Lời giải:
Hiện tượng: Trong quá trình đốt, ta thấy ngọn lửa đèn khí trong từng trường hợp có màu khác nhau:
- Lithium chloride: cho ngọn lửa màu đỏ tía.
- Sodium chloride: cho ngọn lửa màu vàng.
- Potassium chloride: cho ngọn lửa màu tím.
Lời giải:
Ta thấy ngọn lửa có màu đỏ tía.
Vậy dây platinum đã được nhúng vào dung dịch LiOH.
Bài tập
Bài 1 trang 120 Hóa học 12: Các kim loại kiềm khác nhau về những đặc điểm nào sau đây?
(1) Cấu hình electron của nguyên tử.
(2) Số electron hoá trị của nguyên tử.
(3) Số oxi hoá trong các hợp chất.
(4) Mức độ thể hiện tính khử.
Lời giải:
Các kim loại kiềm khác nhau về những đặc điểm:
(1) Cấu hình electron của nguyên tử. Cụ thể: số lớp electron.
(4) Mức độ thể hiện tính khử. Cụ thể: tính khử tăng dần từ Li đến Cs.
Bài 2 trang 120 Hóa học 12: Vì sao trong tự nhiên không tìm thấy đơn chất kim loại kiềm?
Lời giải:
Vì các kim loại kiềm có tính khử rất mạnh, có khả năng tác dụng với nhiều đơn chất, hợp chất trong môi trường ngay ở điều kiện thường để trở thành hợp chất.
Do đó, trong tự nhiên không tìm thấy đơn chất kim loại kiềm.
Với mỗi dung dịch, nhúng đầu dây platinum vào rồi đem đốt trên ngọn lửa đèn khí. Dự đoán hiện tượng xảy ra khi đốt mỗi dung dịch.
Lời giải:
Khi đốt mỗi dung dịch ta thấy:
- Dung dịch soda (Na2CO3): ngọn lửa màu vàng.
- Dung dịch lithium chloride (LiCl): ngọn lửa màu đỏ tía.
- Dung dịch potassium carbonate (K2CO3): ngọn lửa màu tím.
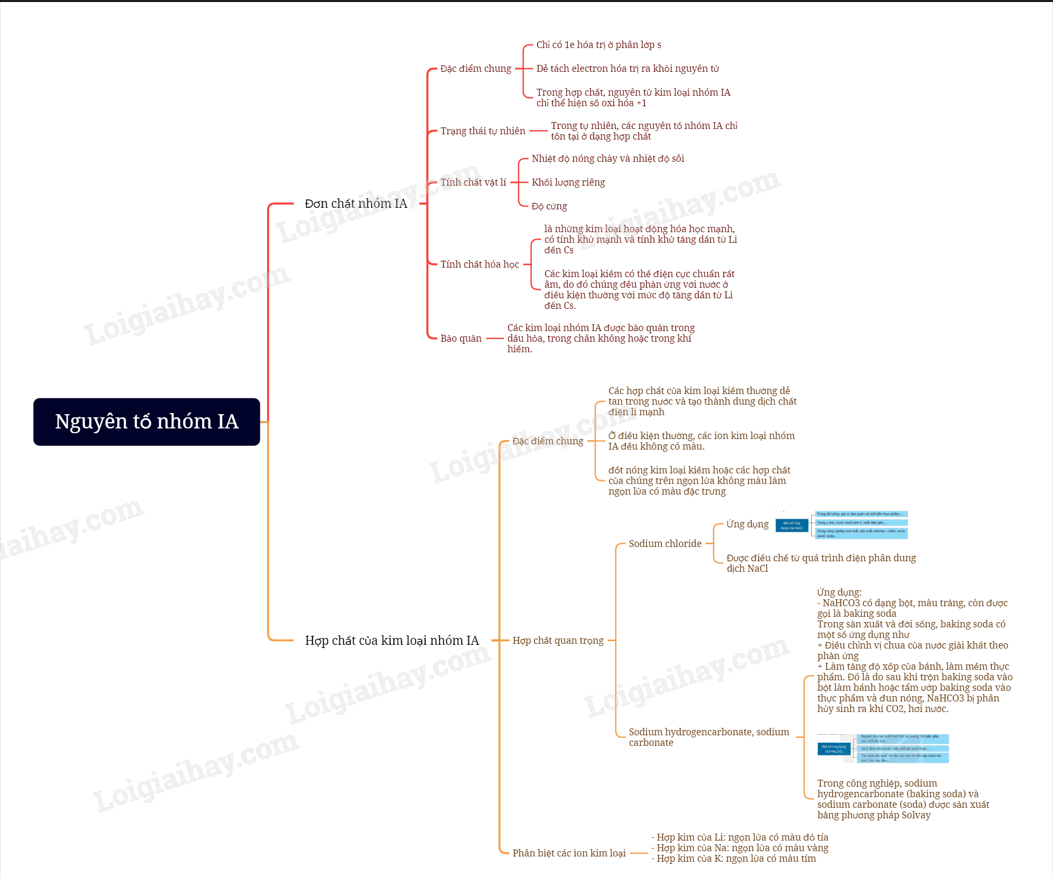
Lý thuyết Nguyên tố nhóm IA
I. Trạng thái tự nhiên
- Nhóm IA gồm các nguyên tố lithium, sodium, potassium, rubidium, caesium và francium. Sodium và potassium phổ biến hơn các nguyên tố còn lại.
- Trong nước mặt, nước ngầm,… các nguyên tố sodium, potassium tồn tại ở dạng cation Na+ và K+
- Kim loại nhóm IA còn được gọi là các kim loại kiềm.
II. Đơn chất
1. Tính chất vật lí
a) Nhiệt độ nóng chảy và nhiệt độ sôi
Nhiệt độ sôi, nhiệt độ nóng chảy của kim loại kiềm có xu hướng giảm từ lithium đến caesium.
b) Khối lượng riêng và độ cứng
Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấo hơn nhiều so với các kim loại nhóm khác. Các kim loại kiềm dễ được cắt nhỏ bởi dao, kéo.
2. Tính chất hóa học
a) Xu hướng chung
Do kim loại kiềm có giá trị rất nhỏ nên chúng có tính khử mạnh: M M+ + e
b) Tác dụng với nước, oxygen và chlorine
Các kim loại kiềm phản ứng mạnh với nước, oxygen, chlorine và nhiều chất oxi hóa khác,… Mức độ phản ứng của kim loại kiềm với chất oxi hóa tăng dần từ lithium đến caesium. Vì vậy:
+ Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại dạng hợp chất.
+ Các kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa khan hoặc trong bình khí hiếm.
III. Hợp chất
1. Khả năng hòa tan trong nước
Ở điều kiện thường, đa số các hợp chất của kim loại kiềm tan tốt trong nước.
2. Một số hợp chất quan trọng
a) Sodium chloride
- Sodium chloride được dùng trong chế biến và bảo quản nthực phẩm, làm nguyên liệu chính của quy trình trong công nghiệp chlorine – kiềm.
- Các sản phẩm của công nghiệp chlorine – kiềm có nhiều ứng dụng.
b) Sodium hydrogencarbonate, sodium carbonate
- Sodium hydrogencarbonate (NaHCO3)
+ NaHCO3 có dạng bột, màu trắng, còn được gọi là baking soda.
- Trong sản xuất và đời sống, baking soda có một số ứng dụng như
+ Điều chỉnh vị chua của nước giải khát theo phản ứng.
+ Làm tăng độ xốp của bánh, làm mềm thực phẩm. Đó là do sau khi trộn baking soda vào bột làm bánh hoặc tẩm ướp baking soda vào thực phẩm và đun nóng, NaHCO3 bị phân hủy sinh ra khí CO2, hơi nước.
- Sodium carbonate (Na2CO3)
+ Na2CO3 có dạng bột, màu trắng còn được gọi là soda.
+ Dung dịch soda có môi trường kiềm nên chất béo trong dầu, mỡ bị thủy phân trong dung dịch này. Do đó, soda được sử dụng để tẩy rửa dầu, mỡ bám trên các dụng cụ, thiết bị.
+ Soda thường được dùng để làm mềm nước cúng, làm nguyên liệu quan trọng trong sản xuất thủy tinh, giấy và nhiều hóa chất khác.
+ Lượng lớn soda được sản xuất thep phương pháp Solvay bằn cách cho khí CO2 vào dung dịch chứa sodium chloride bão hòa và ammonia.
3. Phân biệt các ion kim loại
Khi đốt các hợp chất của kim loại kiềm khác nhau trên ngọn lửa đèn khí sẽ thấy ngọn lửa có màu khác nhau:
- Hợp kim của Li: ngọn lửa có màu đỏ tía
- Hợp kim của Na: ngọn lửa có màu vàng
- Hợp kim của K: ngọn lửa có màu tím
Vì vậy, có thể nhận biết hoặc phân biệt các hợp chất của kim loại kiềm dựa vào màu ngọn lửa khi đốt chúng.
Sơ đồ tư duy Nguyên tố nhóm IA
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 16. Hợp kim – Sự ăn mòn kim loại
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất