Lời giải bài tập Hóa học lớp 12 Bài 15: Tách kim loại và tái chế kim loại sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 15: Tách kim loại và tái chế kim loại
a) Việc lựa chọn phương pháp phù hợp để tách kim loại từ hợp chất cần dựa vào cơ sở nào?
b) Vì sao cần phải tái chế kim loại?
Lời giải:
a) Việc lựa chọn phương pháp phù hợp để tách kim loại từ hợp chất cần dựa trên độ hoạt động của kim loại đó.
+ Phương pháp nhiệt luyện thường dùng để tách các kim loại hoạt động trung bình và yếu như Zn, Fe, Sn, Pb, Cu, … ra khỏi các oxide bằng các chất khử phù hợp và phổ biến như C, CO, … ở nhiệt độ cao.
+ Phương pháp thủy luyện thường để tách những kim loại hoạt động hóa học yếu như Cu, Ag, Au, … ra khỏi dung dịch muối của chúng bằng các kim loại có tính khử mạnh hơn như Fe, Zn, …
+ Phương pháp điện phân thường dùng để tách các kim loại hoạt động mạnh như kim loại thuộc nhóm IA, IIA và nhôm ra khỏi hợp chất của chúng ở trang thái nóng chảy.
Ngoài ra, phương pháp điện phân cũng có thể được áp dụng để điều chế các kim loại hoạt động trung bình và yếu như Zn, Cu, Ag, … bằng cách điện phân hợp chất của chúng trong dung dịch.
b) Do nhu cầu sử dụng kim loại của con người ngày càng lớn. Trong khi đó nguồn quặng để sản xuất kim loại ngày càng cạn kiệt, quá trình khai thác quặng và tách kim loại từ quặng tiêu tốn nhiều năng lượng, đồng thời tác động tiêu cực đến môi trường. Vì vậy việc tái chế kim loại từ phế liệu kim loại là rất cần thiết, vừa đáp ứng nhu cầu sử dụng, vừa góp phần bảo vệ tài nguyên và môi trường.
Một mẫu khoáng vật vàng
Lời giải:
Bạc, vàng là những kim loại có giá trị thế điện cực chuẩn cao, độ hoạt động hóa học yếu. Do đó hầu như không tác dụng với các đơn chất và hợp chất có trong tự nhiên. Vì vậy, vàng, bạc có thể tồn tại ở dạng đơn chất trong tự nhiên.
Lời giải:
Thành phần chính của khoáng vật calcite là CaCO3.
Nước tự nhiên ở khu vực có khoáng vật calcite thường chứa cation kim loại Ca2+.
Hãy tìm hiểu và cho biết một số mỏ kim loại quan trọng ở Việt Nam.
Lời giải:
Một số mỏ kim loại quan trọng ở Việt Nam:
+ Mỏ quặng Urani ở Nông Sơn (Quảng Nam)
+ Mỏ quặng nhôm ở Đắk Nông và Konplon – An Khê (Gia Lai)
+ Mỏ quặng đồng ở Sinh Quyền (Lào Cai); Yên Châu (Sơn La) …
…
Luyện tập 1 trang 102 Hóa học 12: Chỉ ra chất khử được sử dụng trong các phản ứng ở Ví dụ 1.
Lời giải:
+ Phản ứng: Fe2O3(s) + 3CO(g) 2Fe(l) + 3CO2(g)
Chất khử được sử dụng là: CO.
+ Phản ứng: ZnO(s) + C(s) Zn(g) + CO(g)
Chất khử được sử dụng là: C.
+ Phản ứng: Fe(s) + CuSO4(aq) ⟶ Cu(s) + FeSO4(aq)
Chất khử được sử dụng là: Fe.
Lời giải:
|
Phương pháp nhiệt luyện |
Phương pháp thủy luyện |
|
- Nguyên tắc: Dùng các chất khử phù hợp và phổ biến như C, CO, … khử ion kim loại trong oxide của chúng ở nhiệt độ cao. - Thường dùng để tách các kim loại hoạt động trung bình và yếu như Zn, Fe, Sn, Pb, Cu, … |
- Nguyên tắc: Dùng các kim loại có tính khử mạnh như Fe, Zn, … đẩy kim loại yếu hơn ra khỏi dung dịch muối của nó. - Thường dùng để tách những kim loại hoạt động hóa học yếu như Cu, Ag, Au, … |
Lời giải:
Phương trình hóa học của phản ứng tách nhôm từ aluminium oxide bằng phương pháp điện phân nóng chảy.
2Al2O3(l) 4Al(l) + 3O2(g)
Trong đó, tại anode và cathode xảy ra các quá trình sau:
Anode (+): 2O2- ⟶ O2 + 4e
Cathode (−): Al3+ + 3e ⟶ Al
Lời giải:
Để tách kim loại sodium từ hợp chất sodium chloride ta dùng phương pháp điện phân sodium chloride nóng chảy.
Phương trình hóa học:
2NaCl(l) 2Na(l) + Cl2(g)
Giải thích: Do Na là kim loại hoạt động hóa học mạnh và tác dụng được với nước ngay ở nhiệt độ thường nên không thể dùng kim loại mạnh hơn đẩy ra Na ra khỏi dung dịch muối hay điện phân dung dịch.
Câu hỏi 4 trang 103 Hóa học 12: Cho biết một số phế liệu có thể dùng để tái chế nhôm.
Lời giải:
Một số phế liệu được dùng để tái chế nhôm: vỏ lon bia, vỏ lon nước ngọt; giấy nhôm và khay nướng bằng nhôm; rổ, thau, chậu, nồi, mâm nhôm cũ; thanh treo đồ, móc quần áo cũ; đầu xi lanh xe hơi; hệ thống cáp điện; …
Lời giải:
Hình dưới đây liên quan đến công đoạn tạo vật liệu từ kim loại nóng chảy trong quá trình tái chế kim loại.
Lời giải:
Quy trình tái chế nhôm thủ công và nguyên nhân gây ô nhiễm môi trường:
+ Thu gom, phân loại phế liệu nhôm: Nhôm phế liệu được thu gom và phân thành 2 loại nhôm cứng (có lẫn một số kim loại như kẽm, đồng, …) và nhôm dẻo (đồ nhôm nát như xoong, nồi, chậu…). Công đoạn này bao gồm hoạt động đập, hay thu nhỏ diện tích các nguyên liệu phế thải đầu vào, điều này tạo ra tiếng ồn rất lớn. Ngoài ra, phế liệu đầu vào là các sản phẩm không còn sử dụng tiếp, nhiều sản phẩm bị bám bụi do lâu ngày không sử dụng, cộng thêm hoạt động đập, làm nát cũng phát sinh nhiều bụi.
+ Nấu chảy: Công đoạn này yêu cầu lượng lớn nhiên liệu than, để cung cấp nhiệt. Các phản ứng trong quá trình đốt than tạo ra nhiều khí độc hại như: SO2, CO, NOx, … kèm theo đó là bụi trong quá trình nấu, bụi kim loại từ việc nấu phế liệu thải ra. Kết thúc công đoạn này ta sẽ thu được xỉ than và xỉ kim loại.
+ Đúc sản phẩm: Kim loại nóng chảy được đổ vào trong khuôn để tạo hình sản phẩm. Kết thúc công đoạn này là sử dụng nước để làm mát sản phẩm, do đó trong nguồn nước thải ra sẽ chứa một số kim loại, oxide kim loại gây ô nhiễm môi trường nước và đất.
+ Cắt bavia: Đây là công đoạn xử lý các chi tiết thừa trên sản phẩm, có sử dụng các máy móc để cắt, nên trong quá trình sản xuất gây ra tiếng ồn cùng bụi kim loại.
+ Xử lý bề mặt: Trong công đoạn này, các hóa chất có nhiệm vụ tạo bề mặt sản phẩm được như ý và tạo một lớp vỏ bọc cho sản phẩm để tránh các tác động của môi trường đến sản phẩm. Các hóa chất được sử dụng như NaOH, H2SO4, H2CrO4 … do đó đầu ra trong nước thải của công đoạn này chứa nhiều kim loại nặng và acid.
- Như vậy, quá trình tái chế nhôm thủ công ở các làng nghề gây ô nhiễm môi trường:
+ Ô nhiễm tiếng ồn.
+ Ô nhiễm môi trường không khí: Khí thải chứa nhiều tro bụi, CO2, SO2, CO, NOx, …
+ Ô nhiễm môi trường nước, đất: Nước thải chứa nhiều hóa chất như acid, xút, kim loại nặng (Cr) , …
Bài tập
Lời giải:
- Cho magnesium carbonate phản ứng với dung dịch hydrochloric acid dư.
MgCO3(s) + 2HCl(aq) ⟶ MgCl2(aq) + CO2(g) + H2O(l)
- Cô cạn dung dịch sau phản ứng thu được MgCl2 khan.
- Điện phân nóng chảy MgCl2 ta thu được Mg.
MgCl2(l) Mg(l) + Cl2(g)
Lời giải:
Các phương trình hoá học của phản ứng xảy ra:
2ZnS(s) + 3O2(g) 2ZnO(s) + 2SO2(g)
ZnO(s) + C(s) Zn(g) + CO(g)
a) Nêu lợi ích của việc cắt, băm nhỏ phế liệu nhôm trước khi nung chảy.
b) Theo em, có nên dùng nhôm tái chế theo mô tả trên để chế tạo dụng cụ nhà bếp (xoong, chảo, thau,...), dụng cụ y tế không? Vì sao?
Lời giải:
a) Lợi ích của việc cắt, băm nhỏ phế liệu nhôm trước khi nung chảy: giúp giảm bớt thể tích và tiết kiệm nhiên liệu đốt nung nóng chảy.
b) Không nên dùng nhôm tái chế theo mô tả trên để chế tạo dụng cụ nhà bếp (xoong, chảo, thau,...), dụng cụ y tế. Vì các vật dụng bằng nhôm này được sản xuất theo phương thức thủ công và không đảm bảo quy chuẩn chất lượng. Chúng còn lẫn nhiều tạp chất, và được rửa bằng các hóa chất độc hại có thể gây ảnh hưởng lớn đến sức khỏe con người khi sử dụng trực tiếp.
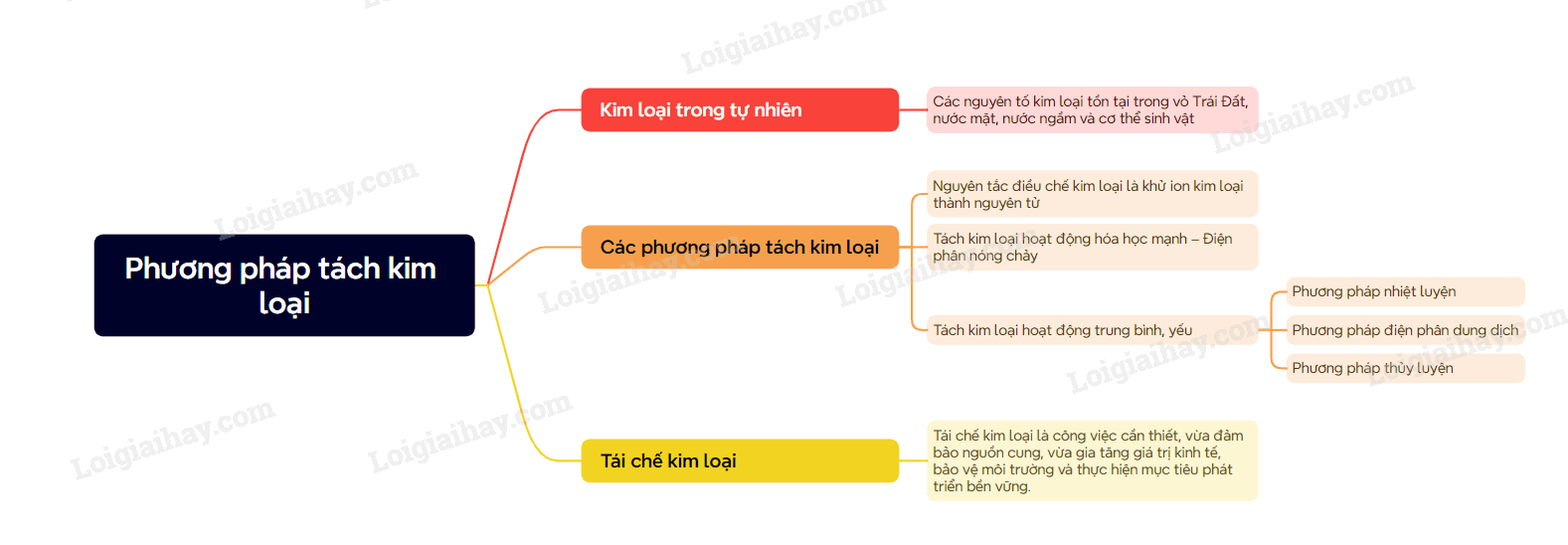
Lý thuyết Tách kim loại và tái chế kim loại
I. Trạng thái tự nhiên của kim loại
Các nguyên tố kim loại tồn tại trong vỏ Trái Đất, nước mặt, nước ngầm và cơ thể sinh vật
+ Trong vỏ Trái Đất, đa số các nguyên tố kim loại tồn tại ở dạng hợp chất oxide và muối không tan, một số kim loại quý tồn tại ở dạng đơn chất và hợp kim
+ Trong nước mặt và nước ngầm, các nguyên tố kim loại tồn tại ở dạng cation như Na+, Mg2+, Ca2+
+ Trong cơ thể sinh vật, nguyên tố calcium có trong xương và răng; các nguyên tố như potassium, sắt, đồng,… có trong máu
II. Phương pháp tách kim loại
1. Phương pháp tách các kim loại hoạt động hóa học trung bình và yếu
- Phương pháp nhiệt luyện: Thường được dùng để tách các kim loại hoạt động hóa học trung bình và yếu như Z, Fe, Sn, Pb, Cu,… ra khỏi các oxide bằng các chất khử phù hợp và phổ biến như C, CO,… ở nhiệt độ cao
- Phương pháp thủy luyện: thường được dùng để tách những kim loại hoạt động hóa học yếu như Cu, Ag, Au,… ra khỏi dung dịch muối của chúng bằng các kim loại có tính khử mạnh như Fe, Zn,….
2. Phương pháp tách kim loại hoạt động hóa học mạnh
Phương pháp điện phân dùng để tách các kim loại hoạt động hóa học mạnh
III. Tái chế kim loại
1. Nhu cầu tái chế kim loại
Nhu cầu sử dụng kim loại của con người ngày càng lớn. Tái chế để đáp ứng nhu cầu sử dụng và góp phần bảo vệ tài nguyên và môi trường.
2. Thực tiễn tái chế kim loại

Sơ đồ tư duy Tách kim loại và tái chế kim loại
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 14. Tính chất hoá học của kim loại
Bài 15. Tách kim loại và tái chế kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại
Bài 19. Nước cứng và làm mềm nước cứng