Lời giải bài tập Hóa học lớp 12 Bài 16: Hợp kim – Sự ăn mòn kim loại sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 16: Hợp kim – Sự ăn mòn kim loại
Hình 16.1. Các công đoạn hoàn thiện vỏ tàu bằng thép
Giải thích ý nghĩa của mỗi việc làm trên.
Lời giải:
Hình 16.1a) Việc sơn phủ lên vỏ tàu giúp hạn chế rỉ sét và bảo vệ kết cấu của vỏ tàu.
Hình 16.1b) Hàn đính một số khối kim loại kẽm vào phần dưới của vỏ tàu bằng thép (thành phần chính là sắt) sẽ tạo thành cặp điện cực Zn – Fe, trong đó Zn là kim loại có tính khử mạnh hơn, đóng vai trò là cực âm nên bị ăn mòn khi tàu tiếp xúc với nước biển, điều này giúp vỏ tàu được bảo vệ.
Hình 16.1c) Việc phủ một lớp sơn cuối cùng giúp cho vỏ tàu tránh tiếp xúc trực tiếp với nước biển, từ đó làm cho sự ăn mòn vỏ tàu diễn ra chậm hơn, đồng thời mang lại tính thẩm mỹ cho con tàu.
Lời giải:
Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim.
Như vậy, khi để trong không khí, bề mặt của lá nhôm bị oxi hoá tạo lớp phủ oxide. Trong trường hợp này lá nhôm không trở thành hợp kim.
Lời giải:
Không nên dùng nhôm làm lưỡi cưa. Vì lưỡi cưa nhôm có tính dẻo cao, dễ bị uốn và dễ bị oxi hóa. Do đó khi cắt với công suất lớn hoặc cắt những vật liệu cứng thường dễ bị gãy lưỡi.
Lời giải:
Để làm tấm khiên cho lực lượng cảnh sát, hợp kim cần phải có những tính chất như bền, cứng cáp để chống va đập, dẻo dai để dễ dát mỏng, nhẹ để thuận tiện cho việc sử dụng và di chuyển.
Trong số các hợp kim, hợp kim duralumin của nhôm thỏa mãn những tính chất trên, do đó phù hợp để làm vật liệu chế tạo khiên trang bị cho lực lượng cảnh sát.
Câu hỏi 3 trang 106 Hóa học 12: Kể tên các đồ dùng, thiết bị được làm bằng thép mà em biết.
Lời giải:
Một số đồ dùng, thiết bị làm bằng thép: Dao, kéo, đường ray tàu hỏa, giàn giáo, khung vỏ các loại tàu xe, trục và bánh răng của các động cơ, …
Lời giải:
- Thép 304 hay còn gọi là inox 304 hoặc thép không gỉ. Đây là hợp kim của Fe và C (< 0,08%), 18% Cr, 8% Ni cùng với một lượng nhỏ các kim loại khác.
- Hai thành phần Cr và Ni được thêm vào để tạo ra loại thép không gỉ này. Cụ thể là:
+ Cr: giúp tăng độ bền của vật liệu, chống mài mòn.
+ Ni: giúp tăng độ cứng mà không làm giảm độ dẻo dai.
- Do vậy, thép 304 được sử dụng rất phổ biến trong đời sống nhờ một số ưu điểm vượt trội như:
+ Khả năng chống ăn mòn, chống gỉ tốt.
+ Khả năng chịu nhiệt cao.
+ Khả năng gia công, tạo hình vượt trội.
+ Sạch sẽ, dễ vệ sinh.
+ Khả năng tái chế 100%.
Lời giải:
Các đồ dùng, thiết bị được làm từ các hợp kim của nhôm: mâm, xoong, ấm nước, tay nắm cửa, vỏ máy bay, pít tông, vành bánh xe, áo giáp, khiên bảo vệ…
Lời giải:
Khớp nối của ống thép là hợp kim của sắt có thành phần chính là sắt và carbon. Ở vị trí khớp nối này có khe hở làm cho nước mưa hoặc hơi nước trong không khí dễ dàng tích tụ ở đó nhiều hơn so với các vị trí còn lại của ống thép. Lớp nước ở khe hở này đã hòa tan khí oxygen và khí carbon dioxide trong khí quyển tạo thành dung dịch chất điện li. Hợp kim của sắt tiếp xúc với dung dịch chất điện li bị ăn mòn điện hóa. Cụ thể sắt là anode và carbon là cathode.
Tại anode: Fe(s) ⟶ Fe2+(aq) + 2e
Tại cathode: O2(g) + H2O(l) + 2e ⟶ 2OH-(aq)
Fe2+ tiếp tục bị oxi hóa bởi O2 trong không khí khi có mặt ion OH- tạo ra gỉ sắt màu nâu đỏ (thành phần chủ yếu là Fe2O3.nH2O).
Lời giải:
Vị trí tấm tôn tiếp xúc với các đinh vít dễ xảy ra hiện tượng ăn mòn điện hóa. Do nơi đây có sự tiếp xúc trực tiếp 2 kim loại khác nhau là kẽm (trên tấm tôn) và sắt (trên đinh vít) hình thành nên cặp điện cực Zn – Fe và cũng là nơi hơi nước hoặc nước mưa dễ đọng lại.
Luyện tập 2 trang 110 Hóa học 12: Nêu các cách hạn chế sự ăn mòn đối với mái tôn.
Lời giải:
Các cách hạn chế sự ăn mòn đối với mái tôn:
- Tráng kẽm lên bề mặt của tấm thép mỏng để sản xuất tôn lợp nhà.
- Sử dụng đinh vít có mạ kẽm.
- Sau khi hoàn thiện việc lắp đặt mái tôn, có thể phun 1 lớp sơn chống rỉ có chứa kẽm lên bề mặt mái tôn.
- Vệ sinh bề mặt mái tôn sạch sẽ và sử dụng sơn dầu quét lên bề mặt giúp bảo vệ mái tôn không bị ăn mòn.
Hình 16.6. Một số biện pháp phủ bề mặt kim loại
Lời giải:
Hình a: Biện pháp phủ một lớp dầu, mỡ lên bề mặt kim loại.
Hình b: Biện pháp tráng lên bề mặt kim loại bằng một kim loại khác.
Hình c: Biện pháp phun sơn lên bề mặt kim loại.
Thí nghiệm trang 111 Hóa học 12: Quan sát video thí nghiệm sau:
Thí nghiệm ăn mòn kim loại và bảo vệ kim loại
Cho một đinh sắt và một đinh sắt đã được quấn dây kẽm vào cùng một cốc thuỷ tinh chứa nước. Cốc này được đặt lên một tờ giấy màu trắng. Để yên khoảng 4 giờ.
Yêu cầu: Quan sát hiện tượng và giải thích.
Lời giải:
Hiện tượng:
- Đinh sắt không có hiện tượng.
- Đinh sắt quấn dây kẽm xảy ra ăn mòn điện hóa. Có kết tủa keo trắng xuất hiện trên bề mặt kẽm.
Giải thích: Đinh sắt quấn dây kẽm xảy ra ăn mòn điện hóa.
- Tại anode: kẽm bị oxi hóa thành ion Zn2+:
Zn(s) ⟶ Zn2+(aq) + 2e
Các electron được chuyển đến cathode.
- Tại cathode: khí oxygen hòa tan trong nước bị khử thành ion OH-:
O2(g) + H2O(l) + 2e ⟶ 2OH-(aq)
Zn2+(aq) + 2OH-(aq) ⟶ Zn(OH)2(s)
Zn(OH)2 là kết tủa ở dạng keo trắng.
Lời giải:
Một số cách chống ăn mòn kim loại đối với cánh cửa làm bằng thép như:
- Mạ một lớp kim loại khác lên bề mặt cánh cửa như Zn, Cr, Ni để tránh cho thép tiếp xúc trực tiếp với các chất trong môi trường, giúp tránh ăn mòn.
- Sơn phủ lên bề mặt cửa và bôi dầu mỡ lên ổ khóa để tránh cho thép tiếp xúc trực tiếp với các chất trong môi trường, giúp giảm tốc độ ăn mòn của kim loại.
Bài tập
Bài 1 trang 112 Hóa học 12: Chỉ ra những điểm giống nhau giữa ăn mòn hoá học và ăn mòn điện hoá.
Lời giải:
Những điểm giống nhau giữa ăn mòn hoá học và ăn mòn điện hoá là:
- Đều là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường.
- Đều xảy ra quá trình oxi hóa khử trong đó kim loại bị oxi hóa.
Lời giải:
Tấm tôn lợp nhà thường được làm từ vật liệu thép tráng kẽm hoặc thép tráng hỗn hợp nhôm và kẽm. Mục đích của việc làm trên là giúp thép được bảo vệ, tránh tiếp xúc trực tiếp với các chất trong môi trường. Từ đó tránh cho tấm tôn bị ăn mòn.
Lời giải:
Phương trình hóa học:
4 + + 2H2S ⟶ 22S + 2H2
Chất khử: Ag
Chất oxi hóa: O2
Bài 4 trang 112 Hóa học 12: Xét thí nghiệm sau:
a) Cho mẩu kẽm vào ống nghiệm chứa dung dịch sulfuric acid loãng.
b) Tiếp tục cho vài giọt dung dịch copper(II) sulfate vào ống nghiệm ở ý a) thì các bọt khí được tạo thành nhanh hơn.
Hãy cho biết trong mỗi giai đoạn trên xảy ra dạng ăn mòn nào. Giải thích.
Lời giải:
Giai đoạn a: xảy ra ăn mòn hóa học theo phản ứng:
Zn(s) + H2SO4(aq) ⟶ ZnSO4(aq) + H2(g)
Giai đoạn b: xảy ra ăn mòn điện hóa vì khi cho dung dịch copper(II) sulfate vào ống nghiệm ở ý a):
CuSO4(aq) + Zn(s) ⟶ ZnSO4(aq) + Cu(s)
Đồng sinh ra bám trên bề mặt mẩu kẽm tạo thành pin điện hóa Zn - Cu với Zn là điện cực âm (anode), Cu là điện cực dương (cathode). Trong đó:
- Tại anode: Zn(s) ⟶ Zn2+(aq) + 2e
- Tại cathode: 2H+(aq) + 2e ⟶ H2(g)
Lời giải:
Một số cách chống ăn mòn kim loại đối với cửa làm bằng kim loại:
- Sử dụng một số vật liệu kháng ăn mòn như thép không gỉ hay hợp kim của nhôm … để làm cửa.
- Mạ cửa kim loại bằng kim loại mạnh hơn như kẽm.
- Phủ một lớp sơn, dầu lên bề mặt cửa.
- Thường xuyên vệ sinh cửa kim loại sạch sẽ, khô ráo.
Lý thuyết Hợp kim – Sự ăn mòn kim loại
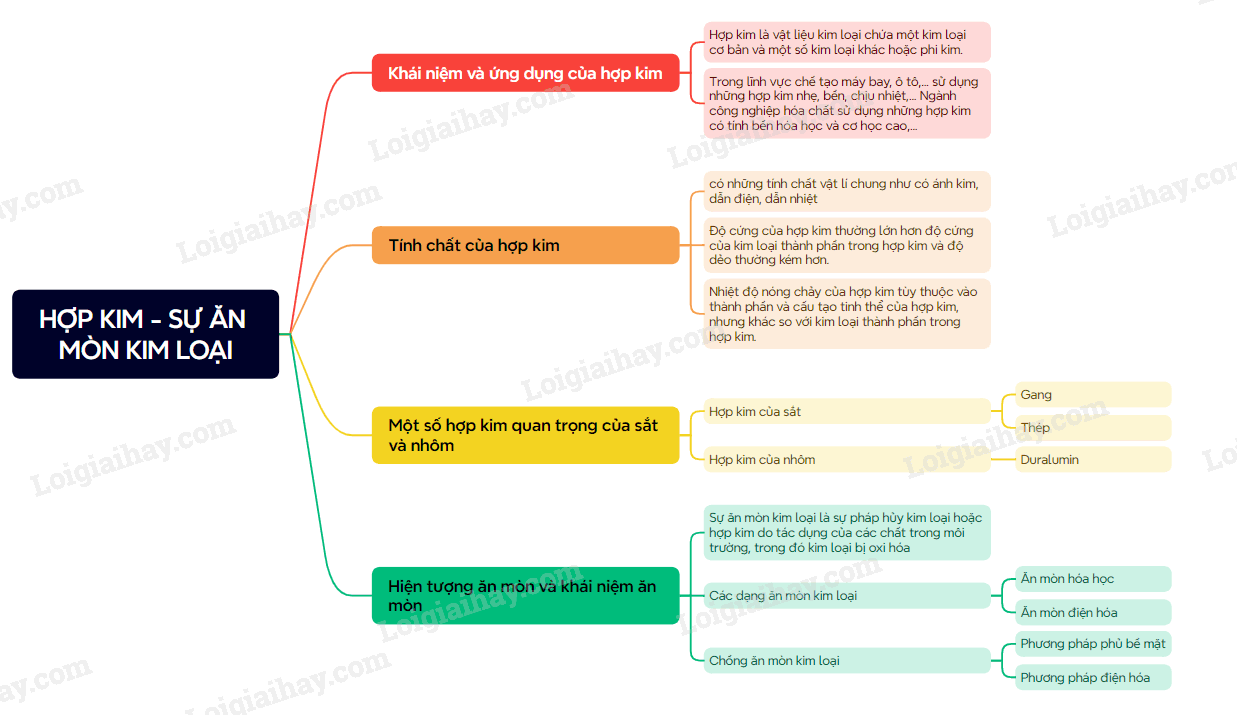
I. Hợp kim
1. Khái niệm hợp kim và việc sử dụng phổ biến của hợp kim
- Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại khác hoặc phi kim. Ví dụ: thép là hợp kim, trong đó kim loại cơ bản là sắt, phu kim là carbon và một số kim loại như chromium, nickel,…
- Hợp kim thường khó bị oxi hóa và có một số tính chất đáp ứng được nhiều mục đích sử dụng khác nhau. Vì vậy trong thực tế, hợp kim được sử dụng phổ biến hơn kim loại.
2. Tính chất của hợp kim
- Tính chất hóa học của hợp kim thường tương tự tính chất hóa học của các đơn chất thành phần tham gia tạo hợp kim.
- Tính chất vật lí và tính chất cơ học của hợp kim thường khác nhiều so với tính chất của các đơn chất thành phần tham gia tạo hợp kim.
3. Một số hợp kim của sắt và nhôm
a) Hợp kim của sắt
hầu hết các hợp kim của sắt là thép. Các loại thép có thành phần khác nhau nên tính chất và ứng dụng khác nhau.
Ví dụ:
- Fe và C tạo thép thường, có độ cứng và độ dẻo phù hợp để làm vật liệu trong ngành xây dựng, giao thông và cơ khí.
- Fe, C, Cr và Ni tạo thép không giả, được dùng làm vật liệu chế tạo dao, kéo, dụng cụ phẫu thuật,…
- Gang là hợp kim của sắt và carbon, trong đó có hàm lượng C lớn hơn so với thép. Gang có độ cứng cao nhưng giòn nên khó gia công hơn thép.
b) Hợp kim của nhôm
- Đặc điểm nổi bật nhất của hợp kim nhôm là nhẹ.
- Duralumin (hay dural) là loại hợp kim quan trọng nhất của nhôm, có thành phần gồm nhôm, đồng, magnesium, manganese,…được sử dụng nhiều trong lĩnh vực hàng không vũ trụ để chế tạo cánh máy bay; lĩnh vực quốc phòng để chế tạo áo giáp khiên bảo vệ; lĩnh vực chế tạo ô tô,…
II. Ăn mòn kim loại
1. Hiện tượng ăn mòn và khái niệm ăn mòn
Sự ăn mòn kim loại là sự pháp hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường, trong đó kim loại bị oxi hóa: M Mn+ + ne
2. Các dạng ăn mòn kim loại
a) Ăn mòn hóa học
Ăn mòn hóa học là quá trình oxi hóa – khử, trong đó các electron của kim loại chuyển trực tiếp đến các chất trong môi trường.
b) Ăn mòn điện hóa
Ăn mòn điện hóa là quá trình ăn mòn kim loại do sự tạo thành pin điện hóa.
Điều kiện xảy ra sự ăn mòn điện hóa
1. Có hai kim loại khác nhau hoặc kim loại với phi kim,…
2. Tiếp xúc trực tiếp với nhau hoặc gián tiếp qua dây dẫn điện
3. Cùng tiếp xúc với một dung dịch chất điện li
Thiếu một trong ba điều kiện trên sẽ không xảy ra sự ăn mòn điện hóa
3. Chống ăn mòn kim loại
a) Phương pháp phủ bề mặt
Phương pháp bảo vệ bề mặt là phủ lên bề mặt của kim loại một lớp sơn, dầu, mỡ, chất dẻo hoặc tráng, mạ bằng một kim loại khác.
b) Phương pháp điện hóa
Trong phương pháp điện hóa, để bảo vệ kim loại, người ta nối kim loại cần bảo vệ với một kim loại hoạt động hóa học mạnh hơn.
Sơ đồ tư duy Hợp kim - Sự ăn mòn kim loại
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 15. Tách kim loại và tái chế kim loại
Bài 16. Hợp kim – Sự ăn mòn kim loại
Bài 19. Nước cứng và làm mềm nước cứng
Bài 20. Sơ lược về kim lại chuyển tiếp dãy thứ nhất